「遺伝子」の版間の差分
編集の要約なし タグ: ビジュアルエディター モバイル編集 モバイルウェブ編集 |
本文内のRubyテンプレートを削除 |
||
| (3人の利用者による、間の6版が非表示) | |||
| 1行目: | 1行目: | ||
{{otheruses||中西圭三のアルバム|遺伝子 (中西圭三のアルバム)}} |
{{otheruses||中西圭三のアルバム|遺伝子 (中西圭三のアルバム)}} |
||
[[生物学]]において、'''遺伝子'''(いでんし、{{Lang-en-short|gene}}、{{Lang-el|γένος}})という言葉には2つの意味がある。メンデル遺伝子は、[[遺伝]]の基本単位である。分子遺伝子は、[[デオキシリボ核酸|DNA]]内の[[ヌクレオチド]]配列であり、転写されて機能的な[[リボ核酸|RNA]]を生成する。この分子遺伝子にはタンパク質コード遺伝子と非コード遺伝子の2種類がある<ref name="mendgene2" /><ref name="MedlinePlus 2020">{{cite web | title=What is a gene?: MedlinePlus Genetics | website=MedlinePlus | date=2020-09-17 | url=https://medlineplus.gov/genetics/understanding/basics/gene/ | access-date=2021-01-04}}</ref><ref name="Hirsch 2002 p.">{{cite book | vauthors = Hirsch ED | title=The new dictionary of cultural literacy | publisher=Houghton Mifflin | publication-place=Boston | year=2002 | isbn=0-618-22647-8 | oclc=50166721}}</ref><ref>{{Cite web|title=Studying Genes |url= https://www.nigms.nih.gov/education/fact-sheets/Pages/studying-genes.aspx |access-date=2021-01-15|website=nigms.nih.gov}}</ref>。 |
|||
{{複数の問題 |
|||
| 出典の明記 = 2023年11月8日 (水) 06:02 (UTC) |
|||
| 独自研究 = 2023年11月8日 (水) 06:02 (UTC) |
|||
}} |
|||
[[遺伝子発現|遺伝子が発現]]するとき、まずDNAがRNAに[[転写 (生物学)|転写]]される。RNAには[[ノンコーディングRNA|直接機能する]]ものもあれば、[[タンパク質合成]]の中間鋳型となるものもある。 |
|||
{{Expand English|date=2023-11-08}} |
|||
生物の{{Ill2|子孫 (生物学)|en|Offspring|label=子孫}}へ遺伝子を伝達することは、ある世代から次の世代へ表現型[[形質]]を継承する基礎をなす。これらの遺伝子は、特定の[[種 (分類学)|種]]の[[個体群|集団]]からなる[[遺伝子プール|遺伝子供給源]]で、個体ごとに特異的な[[遺伝型]]と呼ばれるDNA配列を構成する。遺伝型は、環境因子や発達因子とともに、最終的には個体の[[表現型]]を決定する。ほとんどの生物学的な形質は、[[ポリジーン遺伝|多遺伝子]](異なる遺伝子の集合)と{{Ill2|遺伝子-環境相互作用|en|Gene–environment interaction}}が関わる複合的な影響下で発生する。遺伝形質には、花の色や背の高さのようにすぐに分かるものもあれば、[[血液型]]や特定の病気のリスク、あるいは[[生命]]を構成する何千もの基本的な[[生化学]]的過程など、そうでないものもある。 |
|||
[[Image:Gene.png|right|thumbnail|270px|遺伝子 (gene) は[[デオキシリボ核酸|DNA]]二重らせん構造からなり、それがさらに巻いた構造をとり[[染色体]]を成す。[[真核生物]]の染色体はXのような形をとる。]] |
|||
遺伝子はその配列内に[[変異]]を獲得し、[[個体群|集団]]の中で[[アレル]]と呼ばれる多様体([[変形|変異体]])をもたらすことがある。これらのアレルは遺伝子のわずかに異なる改版を[[遺伝コード|コード]](符号化)しており、異なる表現型形質を引き起こす可能性がある<ref>{{cite book | vauthors = Elston RC, Satagopan JM, Sun S | title = Statistical Human Genetics | chapter = Genetic terminology | series = Methods in Molecular Biology | volume = 850 | pages = 1–9 | date = 2012 | pmid = 22307690 | pmc = 4450815 | doi = 10.1007/978-1-61779-555-8_1 | isbn = 978-1-61779-554-1 | publisher = Humana Press }}</ref>。遺伝子は[[自然選択説|自然選択]]/[[適者生存]]とアレルによる[[遺伝的浮動]]によって[[進化]]する。 |
|||
{{読み仮名|'''遺伝子'''|いでんし}}は、ほとんどの[[生物]]において'''[[デオキシリボ核酸|DNA]]'''を[[担体]]とし、その[[塩基配列]]にコードされる[[遺伝情報]]である。ただし、[[RNAウイルス]]では[[リボ核酸|RNA]]配列にコードされている。 |
|||
遺伝子という用語は、1909年にデンマークの植物学者、植物生理学者、遺伝学者である[[ウィルヘルム・ヨハンセン]]によって導入された<ref name="Johannsen">{{cite book | vauthors = Johannsen W |title=Elemente der exakten Erblichkeitslehre |trans-title=Elements of the exact theory of heredity |date=1909 |publisher=Gustav Fischer |location=Jena, Germany |page=124 |url=https://www.biodiversitylibrary.org/item/15717#page/134/mode/1up |language=German}} From p. 124: ''"Dieses "etwas" in den Gameten bezw. in der Zygote, … – kurz, was wir eben Gene nennen wollen – bedingt sind."'' (This "something" in the gametes or in the zygote, which has crucial importance for the character of the organism, is usually called by the quite ambiguous term ''Anlagen'' [primordium, from the German word ''Anlage'' for "plan, arrangement ; rough sketch"]. Many other terms have been suggested, mostly unfortunately in closer connection with certain hypothetical opinions. The word "pangene", which was introduced by Darwin, is perhaps used most frequently in place of ''Anlagen''. However, the word "pangene" was not well chosen, as it is a compound word containing the roots ''pan'' (the neuter form of Πας all, every) and ''gen'' (from γί-γ(ε)ν-ομαι, to become). Only the meaning of this latter [i.e., ''gen''] comes into consideration here ; just the basic idea – [namely,] that a trait in the developing organism can be determined or is influenced by "something" in the gametes – should find expression. No hypothesis about the nature of this "something" should be postulated or supported by it. For that reason it seems simplest to use in isolation the last syllable ''gen'' from Darwin's well-known word, which alone is of interest to us, in order to replace, with it, the poor, ambiguous word ''Anlage''. Thus we will say simply "gene" and "genes" for "pangene" and "pangenes". The word gene is completely free of any hypothesis ; it expresses only the established fact that in any case many traits of the organism are determined by specific, separable, and thus independent "conditions", "foundations", "plans" – in short, precisely what we want to call genes.)</ref>。これは、子孫や生殖を意味する[[古代ギリシア語|古代ギリシャ語]]の γόνος(''{{Transl|el|[[wiktionary:γένος|génos]]}}'')に由来する<ref name="jeans">{{cite web |url= https://www.genome.gov/25520244/online-education-kit-1909-the-word-gene-coined|title=1909: The Word Gene Coined|website=genome.gov|access-date=8 March 2021}} "...[[:en:Wilhelm Johannsen|Wilhelm Johannsen]] coined the word gene to describe the [[:en:Mendelian inheritance#History|Mendelian units of heredity]]..."</ref><ref name="Roth p.">{{cite journal | vauthors = Roth SC | title = What is genomic medicine? | journal = Journal of the Medical Library Association | volume = 107 | issue = 3 | pages = 442–448 | date = July 2019 | pmid = 31258451 | pmc = 6579593 | doi = 10.5195/jmla.2019.604 | publisher = University Library System, University of Pittsburgh }}</ref>。 |
|||
== 概念 == |
|||
[[分子生物学]]における最狭義の遺伝子は[[タンパク質]]の[[一次構造]]に対応する転写産物 (mRNA) の情報を含む核酸分子上の特定の領域='''[[構造遺伝子]]'''(シストロン)をさす。[[転写因子]]結合部位として、転写産物の転写時期と生産量を制御する[[プロモーター]]や[[エンハンサー]]などの隣接した'''転写調節領域'''を遺伝子に含める場合もある(→[[オペロン]])。ちなみに、語感が似る調節遺伝子とは上記の[[転写因子]]のタンパク質をコードしたれっきとした構造遺伝子である。 |
|||
しかし、転写産物そのものが機能を持ち、タンパク質に翻訳されない、転移RNA (tRNA) やリボソームRNA (rRNA) 、機能性[[ノンコーディングRNA]]に対応する遺伝情報が、タンパク質構造遺伝子と同程度の数をもつことが報告され、狭義の遺伝子に含められるようになっている。 |
|||
== 定義 == |
|||
古典的な'''遺伝子'''の定義は、[[ゲノム]]もしくは[[染色体]]の特定の位置に占める[[遺伝]]の単位(→[[遺伝子座]])であり、構造は変化しないと考えられていた。しかし突然変異や[[トランスポゾン]](可動性遺伝子)の発見、抗体産生細胞で多種の抗体を作り出すための遺伝子再編成の発見などから、分子生物学的実験対象としての遺伝子の概念はたびたび修正を余儀なくされた。 |
|||
一口に「遺伝子」といっても、遺伝、選択、生物学的機能、あるいは分子構造など、さまざまな側面に基づいて、さまざまな用途で使われているが、これらの定義のほとんどはメンデル遺伝子または分子遺伝子の2つに区分される<ref name="mendgene2">{{cite journal | vauthors = Orgogozo V, Peluffo AE, Morizot B | title = The "Mendelian Gene" and the "Molecular Gene": Two Relevant Concepts of Genetic Units | journal = Current Topics in Developmental Biology | volume = 119 | pages = 1–26 | date = 2016 | pmid = 27282022 | doi = 10.1016/bs.ctdb.2016.03.002 | s2cid = 24583286 | url = https://hal.archives-ouvertes.fr/hal-01354346/file/Orgogozo2016-gene.pdf }}</ref><ref name="Kampourakis" /><ref name="Gericke">{{cite journal |vauthors=Gericke N, Hagberg M |date=5 December 2006 |title=Definition of historical models of gene function and their relation to students' understanding of genetics |journal=Science & Education |volume=16 |issue=7–8 |pages=849–881 |bibcode=2007Sc&Ed..16..849G |doi=10.1007/s11191-006-9064-4 |s2cid=144613322}}</ref><ref>{{cite web |url= https://plato.stanford.edu/entries/gene/ |title= Stanford Encyclopedia of Philosophy: Gene| vauthors = Meunier R |date= 2022 |website= Stanford Encyclopedia of Philosophy |access-date= 2023-02-28 }}</ref><ref>{{cite journal |display-authors=6 |vauthors=Kellis M, Wold B, Snyder MP, Bernstein BE, Kundaje A, Marinov GK, Ward LD, Birney E, Crawford GE, Dekker J, Dunham I, Elnitski LL, Farnham PJ, Feingold EA, Gerstein M, Giddings MC, Gilbert DM, Gingeras TR, Green ED, Guigo R, Hubbard T, Kent J, Lieb JD, Myers RM, Pazin MJ, Ren B, Stamatoyannopoulos JA, Weng Z, White KP, Hardison RC |date=April 2014 |title=Defining functional DNA elements in the human genome |journal=Proceedings of the National Academy of Sciences of the United States of America |volume=111 |issue=17 |pages=6131–8 |bibcode=2014PNAS..111.6131K |doi=10.1073/pnas.1318948111 |pmc=4035993 |pmid=24753594 |doi-access=free}}</ref>。 |
|||
メンデル遺伝子({{Lang-en-short|Mendelian gene}})は遺伝学の古典的な遺伝子であり、あらゆる遺伝性の形質を指す。これは[[リチャード・ドーキンス|ドーキンス]]の著書『[[利己的な遺伝子]]』に記述された遺伝子である<ref name="Dawkins_2018">{{Cite book|和書 |title=利己的な遺伝子 40周年記念版 |date=2018-02-15 |year=2018 |publisher=紀伊國屋書店 |isbn=978-4314011532 |author=ドーキンス,リチャード |translator=日高敏隆/岸由二/羽田節子/垂水雄二}}</ref>。この区分の遺伝子についてのより詳細な議論は、{{Ill2|遺伝学|en|Genetics|preserve=1}}と{{ill2|遺伝子中心の進化観|en|Gene-centered view of evolution}}の記事を参照のこと。 |
|||
また同じ生物学内でも[[進化論]]や[[集団遺伝学]]、[[進化ゲーム理論]]での議論で用いられる遺伝子という単語は、上記の[[構造遺伝子]]や[[デオキシリボ核酸|DNA]]上の領域あるいは遺伝子座とは相当に異なる概念を内包しており、混同してはならない(例:[[リチャード・ドーキンス]]の著書表題『The Selfish Gene([[利己的な遺伝子]])』)。こちらは、[[自然選択]]あるいは[[遺伝的浮動]]の対象として集団中で世代をまたいで頻度を変化させうる情報単位である。メンデル遺伝的な面をもつもののほか、表現型に算術平均的影響を与える量的形質遺伝子、遺伝情報の突然変異や組み換えに対応する無限対立遺伝子モデルなど、理論的でありながら、即物的な分子生物学の側面を包含した考え方である。これを模倣し、文化進化の文脈で用いられる[[ミーム]]は集団遺伝学における遺伝子のアナロジーである。 |
|||
一方、分子遺伝子({{Lang-en-short|molecular gene}})の定義は、生化学、分子生物学、そして遺伝学の大部分にわたって、より一般的に使用されており、DNA配列の観点から説明される遺伝子である<ref name="mendgene2" />。この遺伝子にはさまざまな定義があり、その中には誤解を招くものや不正確なものもある<ref name="Kampourakis" /><ref>{{cite journal | vauthors = Stoltz K, Griffiths P | date = 2004 | title = Genes: Philosophical Analyses Put to the Test | journal = History and Philosophy of the Life Sciences | volume = 26 | issue = 1 | pages = 5–28 | doi = 10.1080/03919710412331341621 | jstor = 23333378 | pmid = 15791804 | url = https://www.jstor.org/stable/23333378 }}</ref>。 |
|||
遺伝子という言葉は、「遺伝する因子」としての本来の意味を超えて遺伝子産物の機能までを含んで用いられる場合があり、混乱を誘発している。後者の典型例としては、遺伝しない遺伝子を使った[[遺伝子治療]]などがあげられる。さらに遺伝子やDNAという言葉は、科学的・神秘的といったイメージが先行し、一般社会において[[生物学]]的定義から離れた用いられ方がされていることが多い。それらの大半は通俗的な遺伝観を言い換えたものに過ぎない。一般雑誌などでは[[疑似科学]]的な用法もしばしば見受けられる。 |
|||
[[分子遺伝学]]となったこの分野の非常に初期の研究は、[[一遺伝子一酵素説|1つの遺伝子が1つのタンパク質を作る]]という概念を示唆した(もとは「[[一遺伝子一酵素説]]」)<ref name="pmid16588492">{{cite journal |vauthors=Beadle GW, Tatum EL |date=November 1941 |title=Genetic Control of Biochemical Reactions in Neurospora |journal=Proceedings of the National Academy of Sciences of the United States of America |volume=27 |issue=11 |pages=499–506 |bibcode=1941PNAS...27..499B |doi=10.1073/pnas.27.11.499 |pmc=1078370 |pmid=16588492 |doi-access=free}}</ref><ref name="pmid15020400">{{cite journal |vauthors=Horowitz NH, Berg P, Singer M, Lederberg J, Susman M, Doebley J, Crow JF |date=January 2004 |title=A centennial: George W. Beadle, 1903-1989 |journal=Genetics |volume=166 |issue=1 |pages=1–10 |doi=10.1534/genetics.166.1.1 |pmc=1470705 |pmid=15020400}}</ref>。しかし、1950年代にはリプレッサーRNAを産生する遺伝子が提案され<ref>{{cite book |title=The Eight Day of Creation |vauthors=Judson HF |date=1996 |publisher=Cold Spring Harbor Laboratory Press |edition=Expanded |location=Plainview, NY (US)}}</ref>、1960年代の教科書では既に、タンパク質をコードする遺伝子だけでなく、リボソームRNAやtRNAのような機能的RNA分子(非コード遺伝子)を含めた分子遺伝子の定義が用いられるようになった<ref name="Watson">{{cite book | vauthors = Watson JD | date = 1965 | title = Molecular Biology of the Gene | publisher = W.A. Benjamin, Inc. | place = New York, NY, US }}</ref>。 |
|||
== 機能 == |
|||
[[ファイル:Dna-split.png|thumb|DNA複製]] |
|||
「2種類の遺伝子」というこの考え方は、今でもほとんどの教科書で遺伝子の定義の一部となっている。たとえば次のように説明されている。 |
|||
遺伝子はDNAが[[DNA複製|複製]]されることによって次世代へと受け継がれる。複製はDNAの[[二重らせん]]が解かれて、それぞれの分子鎖に相補的な鎖が新生されることで行われる。 |
|||
<blockquote> |
|||
本質的には情報でしかない遺伝子が機能するためには'''[[遺伝子発現|発現]]'''される必要がある。発現は、一般に[[転写 (生物学)|転写]]と[[翻訳 (生物学)|翻訳]]の過程を経て、[[遺伝情報]](= DNAの塩基配列)が[[タンパク質]]などに変換される過程である。こうしてできたタンパク質が、ある場合は直接特定の生体内化学反応に寄与して化学平衡などに変化をもたらすようになり、ある場合は他の遺伝子の発現に影響を与え、その結果[[形質]]が[[表現型]]として現われてくる。'''転写'''はDNAからRNA([[mRNA]]や[[rRNA]]など)に情報が写し取られる現象であり、'''翻訳'''はmRNAの情報を基にタンパク質が合成される過程である。この過程は[[セントラルドグマ]]とも呼ばれる。 |
|||
『ゲノムの主な機能はRNA分子を作り出すことである。DNAヌクレオチド配列の選択された部分が、対応するRNAヌクレオチド配列に複写され、タンパク質をコードするか(mRNAの場合)、あるいはトランスファーRNA(tRNA)やリボソームRNA(rRNA)分子のような「構造的RNA」を形成する。DNAらせんの各領域が、機能的なRNA分子を生成する遺伝子を構成している。』<ref name="Alberts">{{cite book | vauthors = Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD | date = 1994 | title = Molecular Biology of the Cell: Third Edition | publisher = Garland Publishing, Inc. | place = London, UK | isbn = 0-8153-1619-4}}</ref> |
|||
</blockquote> |
|||
<blockquote> |
|||
== 遺伝子の発現 == |
|||
『遺伝子を「転写されるDNA配列と定義する。この定義には、タンパク質をコードしない遺伝子も含まれる(すべての転写産物がメッセンジャーRNAというわけではない)。この定義では通常、転写を制御してもそれ自体は転写されないゲノムの領域は除外される。この遺伝子の定義に対していくつかの例外が見つかるが、驚くことに、完全に満足のゆく定義は存在しない。』<ref>{{cite book | vauthors = Moran LA, Horton HR, Scrimgeour KG, Perry MD | date = 2012 | title = Principles of Biochemistry: Fifth Edition | publisher = Pearson | place = Upper Saddle River, NJ, US}}</ref> |
|||
[[遺伝子発現]]に関する多くの知見は真核生物ではなく[[細菌]]である[[大腸菌]]を[[モデル生物]]とした実験から得られてきた。 |
|||
</blockquote> |
|||
<blockquote> |
|||
== 真核生物の遺伝子の一般的な働き方 == |
|||
『遺伝子とは、拡散性の産物<!-- diffusible product -->をコードするDNA配列である。この産物はタンパク質であったり(大半の遺伝子が該当)、RNAである場合もある(tRNAやrRNAをコードする遺伝子が該当)。重要な特徴は、その産物が合成部位から拡散して、別の場所で作用することである。』<ref>{{cite book | vauthors = Lewin B | date = 2004 | title = Genes VIII | publisher = Pearson/Prentice Hall | place = Upper Saddle River, NJ, US }}</ref> |
|||
[[細胞核|核]]内では様々なDNA結合特異性を持った[[転写調節因子]]の転写調節領域への結合や、[[DNAメチル化|DNAのメチル化]]状態などで遺伝子の活性が制御されている。[[デオキシリボ核酸|DNA]]から[[RNAポリメラーゼ]]によってRNAへと[[転写 (生物学)|転写]]された転写産物は[[mRNA前駆体]]と呼ばれる。 |
|||
</blockquote> |
|||
このような定義で重要な部分は(1)遺伝子は転写単位に対応すること、(2)遺伝子はmRNAと非コードRNAの両方を生成すること、(3){{Ill2|調節配列|en|Regulatory sequence}}は遺伝子発現を制御するが、遺伝子自体の一部ではないことである。しかし、この定義にはもう一つ重要な部分があり、Kostas Kampourakisの著書「''Making Sense of Genes''」で強調されている。 |
|||
これが、5'末端へのキャップ構造の付加やスプライシング、3'末端の切断、ポリA鎖の付加といった作用を受けてmRNAとなる。mRNAは転写の場である核から核膜孔を通過し[[細胞質]]へ運ばれる。 |
|||
<blockquote> |
|||
細胞質では、キャップ構造を認識する蛋白質や翻訳開始因子との作用により[[リボソーム]]がmRNAに結合する。リボソーム上では、コドンに対応した[[アンチコドン]]を持ったアミノアシル[[tRNA]]がAサイトに結合することで塩基配列からアミノ酸配列への遺伝情報の[[翻訳 (生物学)|翻訳]]が行われる。Pサイトに結合しているペプチジルtRNAから、アミノ酸が連なったポリペプチドがAサイトのtRNAに付加され、これがPサイトに移動することが繰り返される。 |
|||
『したがって、本書では遺伝子を、タンパク質であれRNA分子であれ、機能的産物の情報をコードするDNA配列として考える。「情報をコードする」とは、DNAの塩基配列が、ある機能を果たすRNA分子やタンパク質を生成するための鋳型として使われるという意味である。』<ref name="Kampourakis">{{cite book | vauthors = Kampourakis K | date = 2017 | title = Making Sense of Genes | publisher = Cambridge University Press | place = Cambridge, UK}}</ref><br /> |
|||
</blockquote> |
|||
機能性を強調することが重要なのは、DNAの中には機能的でない転写産物を生成する領域が存在し、それらは遺伝子と見なされないからである。これらには、転写された偽遺伝子のように明白な例だけでなく、転写エラーによってノイズとして生成されるジャンクRNAのような、あまり明白でない例も含まれる。この定義に従うと、真の遺伝子と見なされるためには、その転写物が生物学的機能を持つことが示されなくてはならない<ref name="Kampourakis" />。 |
|||
翻訳されたアミノ酸配列はその一次構造に依存した立体構造をもつ蛋白質へと折り畳まれる。蛋白質の機能はその立体構造によって規定されており、正常な構造をもつ蛋白質がさらに[[糖鎖]]の付加やリン酸化といった翻訳後の修飾をうけて最終的な遺伝子産物となることもある。 |
|||
典型的な遺伝子のサイズに関する初期の推測は、高解像度の遺伝子マッピングとタンパク質やRNA分子のサイズに基づいていた。1965年当時は、1500塩基対という長さが妥当だと考えられた<ref name="Watson" />。この数字は、遺伝子は機能性産物の生成に直接関与するDNAであるという考えに基づいていた。1970年代のイントロンの発見は、多くの真核生物の遺伝子が、機能性産物のサイズから推定されるよりもはるかに大きいことを意味した。たとえば、典型的な哺乳類のタンパク質をコードする遺伝子は、長さ(転写領域)が約62,000塩基対で、その数は約20,000個であるため、哺乳類ゲノム(ヒトゲノムを含む)の約35-40%を占める<ref>{{cite journal | vauthors = Piovesan A, Pelleri MC, Antonaros F, Strippoli P, Caracausi M, and Vitale L | date = 2019 | title = On the length, weight and GC content of the human genome | journal = BMC Research Notes | volume = 12 | issue = 1 | pages = 106–173 | doi = 10.1186/s13104-019-4137-z| pmid = 30813969 | pmc = 6391780 | doi-access = free }}</ref><ref>{{cite journal | vauthors = Hubé F, and Francastel C | date = 2015 | title = Mammalian Introns: When the Junk Generates Molecular Diversity | journal = International Journal of Molecular Sciences | volume = 16 | issue = 3 | pages = 4429–4452 | doi = 10.3390/ijms16034429 | pmid = 25710723 | pmc = 4394429 | doi-access = free }}</ref><ref>{{cite journal | vauthors = Francis WR, and Wörheide G | date = 2017 | title = Similar ratios of introns to intergenic sequence across animal genomes | journal = Genome Biology and Evolution | volume = 9 | issue = 6 | pages = 1582–1598 | doi = 10.1093/gbe/evx103| pmid = 28633296 | pmc = 5534336 }}</ref>。 |
|||
== 遺伝子研究 == |
|||
一般に、遺伝子研究とは[[遺伝学]]、[[分子生物学]]、[[ゲノミクス]]などの研究を指す。[[集団遺伝学]]や[[進化遺伝学]]は含めないことが多い。 |
|||
タンパク質コード遺伝子も、非コード遺伝子も、50年以上前から知られているにもかかわらず、遺伝子をタンパク質を特定するDNA配列として定義している教科書、ウェブサイト、科学出版物がいまだに数多く存在している。言い換えれば、その定義はタンパク質コード遺伝子に限定されたものである。次の引用は、''[[American Scientist|アメリカン・サイエンティスト]]'' 誌の最近の記事からの一例である。 |
|||
<!--以降、説明の重複や前後関係の混乱などを整理してみた。誤りがあれば修正いただきたい--> |
|||
遺伝子研究は[[グレゴール・ヨハン・メンデル|メンデル]]・[[トーマス・ハント・モーガン|モーガン]]の[[古典遺伝学]]に始まった。古典遺伝学における遺伝子研究は[[メンデルの法則|メンデル]]の行ったような[[交雑実験]]と[[表現型]]の観察を中心とし、遺伝子は遺伝情報を担う粒子の概念として扱われた。 |
|||
<blockquote> |
|||
分子生物学黎明期では主に[[大腸菌]]や[[ファージ]]を用いて、DNAを直接扱う形質転換実験や、DNA塩基配列からの遺伝子発現機構の解析などが行われた。現在では様々な[[モデル生物]]に研究対象が拡大している。これは、遺伝子の実体がほとんど全生物において『DNAである』ことによる(DNAを扱えればいかなる生物でも分子生物学的実験は行える)。 |
|||
... ''de novo''遺伝子の潜在的な重要性を真に評価するために、我々はほぼすべての専門家が同意できる「遺伝子」という言葉の厳密な定義に頼った。まず、ヌクレオチド配列が真の遺伝子とみなされるには、[[オープンリーディングフレーム]](ORF)が存在しなければならない。ORFは「遺伝子そのもの」と考えることができる。ORFは、すべての遺伝子に共通する開始マーカーで始まり、3種類ある終了マーカーのうちの1つで終わる。この過程における重要な酵素の一つである[[RNAポリメラーゼ]]は、モノレールの列車のようにDNA鎖に沿って走行し、DNAをメッセンジャーRNAの形式に転写する。この点が2つ目の重要な基準である。真の遺伝子とは、転写と翻訳の両方が行われるものをいう。つまり、真の遺伝子は、まず一時的なメッセンジャーRNAを作るための鋳型として使われ、次にそれがタンパク質に翻訳されるものである<ref>{{cite journal |vauthors= Mortola E, Long M |date=2021 |title=Turning Junk into Us: How Genes Are Born |url=https://www.americanscientist.org/article/turning-junk-into-us-how-genes-are-born |journal=American Scientist |volume=109 |pages=174–182}}</ref>。 |
|||
</blockquote> |
|||
この限定された定義は一般的であり、そのためこの「標準的な定義」を批判し、非コード遺伝子を含む新しい拡張された定義を求める多くの最近の論文が発表されるほどであった<ref>{{cite journal | vauthors = Hopkin K | date = 2009 | title = The Evolving Definition of a Gene: With the discovery that nearly all of the genome is transcribed, the definition of a "gene" needs another revision | journal = BioScience | volume = 59 | pages = 928–931 | doi = 10.1525/bio.2009.59.11.3| s2cid = 88157272 }}</ref><ref>{{cite journal | vauthors = Pearson H | date = 2006 | title = What Is a Gene? | journal = Nature | volume = 441 | issue = 7092 | pages = 399–401| doi = 10.1038/441398a | pmid = 16724031 | bibcode = 2006Natur.441..398P | s2cid = 4420674 | doi-access = free }}</ref><ref>{{cite journal | vauthors = Pennisi E | date = 2007 | title = DNA study forces rethink of what it means to be a gene | journal = Science | volume = 316 | issue = 5831 | pages = 1556–1557 | doi = 10.1126/science.316.5831.1556| pmid = 17569836 | s2cid = 36463252 | doi-access = free }}</ref>。しかし、このいわゆる「新しい」定義は半世紀以上前から存在しており、現代の一部の著者が非コード遺伝子を無視している理由は定かではない{{疑問点|title=<nowiki>英語版 [[:en:Gene#Definitions] ではこの位置に [[:en:Template:Editorializing]] (社説や個人的な意見のように聞こえないような整理が必要) テンプレートが付加されていた。日本語版でもそのまま訳しているため同様であり、利用できる「疑問点」テンプレートで代用した。</nowiki>|date=2024年3月}}。 |
|||
[[突然変異]]の表現型から遺伝子機能を推定する正の遺伝学はマウスなどでは行いづらく、先に遺伝子を同定してから変異体を作成する[[逆遺伝学]]という手法が生まれた。逆遺伝学の先にゲノムプロジェクトがあり、さまざまな生物種で進行または終了している。ゲノムプロジェクトによって遺伝子の数を有限に規定することができる。<!--この説明はどうか?間違ってはいないが妙に限定的過ぎないだろうか?--> |
|||
一部の定義は他の定義よりも広範に適用できるかもしれないが、生物学の基本的な複雑さは、遺伝子の定義がすべての側面を完璧に捉えることができないことを意味する。すべてのゲノムがDNAであるわけではない(たとえば[[RNAウイルス]]を参照)<ref>{{cite journal | vauthors = Wolf YI, Kazlauskas D, Iranzo J, Lucía-Sanz A, Kuhn JH, Krupovic M, Dolja VV, Koonin EV | display-authors = 6 | title = Origins and Evolution of the Global RNA Virome | journal = mBio | volume = 9 | issue = 6 | pages = e02329–18 | date = November 2018 | pmid = 30482837 | pmc = 6282212 | doi = 10.1128/mBio.02329-18 | others = Eric Delwart, Luis Enjuanes | veditors = Racaniello VR }}</ref>。細菌の[[オペロン]]は単一の大きなmRNAに転写される複数のタンパク質コード領域であり、[[選択的スプライシング]]は一つのゲノム領域で複数の区域産物<!-- district products -->をコードすることを可能とし、[[トランススプライシング]]によりゲノム全体に分割された短いコード配列からmRNAが連結される<ref name="Rethink" /><ref>{{cite journal |vauthors=Marande W, Burger G |date=October 2007 |title=Mitochondrial DNA as a genomic jigsaw puzzle |journal=Science |publisher=AAAS |volume=318 |issue=5849 |pages=415 |bibcode=2007Sci...318..415M |doi=10.1126/science.1148033 |pmid=17947575 |s2cid=30948765}}</ref><ref>{{cite journal |display-authors=6 |vauthors=Parra G, Reymond A, Dabbouseh N, Dermitzakis ET, Castelo R, Thomson TM, Antonarakis SE, Guigó R |date=January 2006 |title=Tandem chimerism as a means to increase protein complexity in the human genome |journal=Genome Research |volume=16 |issue=1 |pages=37–44 |doi=10.1101/gr.4145906 |pmc=1356127 |pmid=16344564}}</ref>。分子的定義では、イントロン、プロモーター、その他の{{Ill2|調節配列|en|regulatory sequence|label=調節領域}}などの要素は除外されているため、これらの要素は遺伝子と「関連」し、その機能に影響を与えるものと考えられている。 |
|||
[[デオキシリボ核酸|DNA]]の構造決定と[[ゲノムプロジェクト]]は遺伝子研究に[[パラダイムシフト]]をもたらした。シーケンシング(塩基配列の解析)技術は2009年現在も飛躍的に進歩し続けており、高速かつ低コストにゲノム全体を網羅的に解析できるようになりつつある。単に塩基配列を知るというレベルではなく、個体差を比較したり、遺伝子の発現パターンをプロファイリングしたりといった、従来は困難と認識されてきた研究も現実的に可能となってきた。[[in vivo]]における遺伝子の機能、すなわち『遺伝子はどのように生物体で機能しているのか』という問いへの答えが明らかになりつつある。 |
|||
このような多様で複雑な現象を包含するために、より広範な実用的定義が用いられることもある。この場合、遺伝子は、潜在的に重畳する機能産物がまとまった集まりをコードするゲノム配列の連合体として定義される<ref name="Gerstein">{{cite journal |display-authors=6 |vauthors=Gerstein MB, Bruce C, Rozowsky JS, Zheng D, Du J, Korbel JO, Emanuelsson O, Zhang ZD, Weissman S, Snyder M |date=June 2007 |title=What is a gene, post-ENCODE? History and updated definition |journal=Genome Research |volume=17 |issue=6 |pages=669–81 |doi=10.1101/gr.6339607 |pmid=17567988 |doi-access=free}}</ref>。この定義は、遺伝子を特定のDNA座位ではなく、その機能的産物(タンパク質またはRNA)によって分類し、調節エレメントは遺伝子関連領域として分類する<ref name="Gerstein" />。 |
|||
=== 遺伝子操作の概要 === |
|||
遺伝子の機能を調べるにはいくつかのテクニックが必要である。生物体内 (in vivo) における特定の遺伝子はいくつかのコピーが存在するものの、その遺伝子が何を意味しているのか、発現するとどうなるのか、変異が起こればどうなるのかを調べることは困難である。したがって、その遺伝子のみを取り出して、遺伝子の特性を生物体外 ([[in vitro]]) で調べる必要がある。それらの過程には |
|||
==歴史== |
|||
# [[クローニング]]:扱いやすくするために対象遺伝子を担うDNAの数を増やす |
|||
{{main|{{ill2|遺伝学の歴史|en|History of genetics}}}} |
|||
# [[シークエンシング]]:遺伝子の配列を読む |
|||
# [[過剰発現系|過剰発現]]:遺伝子をタンパク質に翻訳し、その機能を理解する |
|||
=== 離散的遺伝単位の発見 === |
|||
の三段階を経る。クローニングや発現の前には、サブクローニングや発現ベクターへの遺伝子の導入といったプロセスを経ることもある。 |
|||
[[File:Gregor Mendel.png|thumb|upright=0.8|[[グレゴール・メンデル]]|alt=Photograph of Gregor Mendel]] |
|||
離散的遺伝単位({{Lang-en-short|discrete inheritable units}})の存在は、[[グレゴール・メンデル]](1822-1884)によって初めて提案された<ref>{{cite journal | vauthors = Noble D | title = Genes and causation | journal = Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences | volume = 366 | issue = 1878 | pages = 3001–15 | date = September 2008 | pmid = 18559318 | doi = 10.1098/rsta.2008.0086 | doi-access = free | bibcode = 2008RSPTA.366.3001N }}</ref>。1857年から1864年にかけて、[[オーストリア帝国]]の[[ブルノ]](現在のチェコ共和国)で、彼は8,000株の一般的な食用[[エンドウ豆]]の遺伝パターンを研究し、親から子への明確な形質を追跡した。彼はこれらの遺伝パターンを2<sup>n</sup> 個の組み合わせとして数学的に説明した(ここで、nは元のエンドウ豆の異なる特徴の数)。彼は遺伝子という言葉は使用しなかったが、観察可能な物理的特徴をもたらす離散的な遺伝単位という観点から自らの結果を説明した。この説明は、[[ウィルヘルム・ヨハンセン]]による[[遺伝型]](生物の遺伝物質)と[[表現型]](その生物の観察可能な形質)の区別を先取りしていた。メンデルはまた、独立組合せ({{Lang-en-short|independent assortment}})、顕性形質({{Lang-en-short|dominant traits}})と潜性形質({{Lang-en-short|recessive traits}})の区別、[[ヘテロ接合体]]と[[ホモ接合体]]の区別、および不連続遺伝の現象を初めて実証した。 |
|||
=== クローニング === |
|||
クローニングとは、遺伝子のクローンを作成する実験である。遺伝子のクローンを作成するにはある程度の配列がわかっていることを前提に現在2つの方法が実用化されている。 |
|||
メンデルの研究以前は、遺伝の主流は{{Ill2|融合遺伝|en|Blending inheritance|label=融合遺伝説}}であり、受精の過程でそれぞれの親が体液を提供し、両親の形質が混ざり合って子孫を残すと考えられていた<ref>{{Cite web |url=https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/blending-inheritance |title=Blending Inheritance - an overview | ScienceDirect Topics |access-date=2021-07-03}}</ref>。[[チャールズ・ダーウィン]]は、ギリシャ語のパン(pan、すべて・全体)とジェネシス(genesis、誕生)/ジェノス(genos、起源)を語源とする[[パンゲネシス]](pangenesis、パンゲン説)と呼ばれる遺伝理論を展開した<ref>{{OED|genesis}}</ref><ref>{{cite book | vauthors = Magner LN |title = A History of the Life Sciences |edition = Third |publisher = [[:en:Marcel Dekker|Marcel Dekker]], [[:en:CRC Press|CRC Press]] |year = 2002 |isbn = 978-0-203-91100-6 |url = https://books.google.com/books?id=YKJ6gVYbrGwC|page=371}}</ref>。ダーウィンは、{{Ill2|ジェミュール|en|Gemmule (pangenesis)|label=ジェミュール}}(''gemmule'')という言葉を使って、生殖の際に混ざり合う仮説上の粒子を表現した。 |
|||
* ゲノムDNAを[[制限酵素]]で切断し、[[サザンブロッティング]]で目的遺伝子を含む配列を同定する方法 |
|||
* [[ポリメラーゼ連鎖反応|PCR]]法を用いて目的の遺伝子配列を増幅する方法 |
|||
メンデルの研究は1866年に初めて発表されて以来、ほとんど注目されることはなかったが、19世紀後半に[[ユーゴー・ド・フリース]]、[[カール・エーリヒ・コレンス]]、[[エーリヒ・フォン・チェルマク]]らによって再発見され、彼らは自らの研究で同様の結論に達した(と主張した)<ref>{{cite book | vauthors = Henig RM |title=The Monk in the Garden: The Lost and Found Genius of Gregor Mendel, the Father of Genetics |publisher=Houghton Mifflin |location=Boston |year=2000 |isbn=978-0395-97765-1 |pages=[https://archive.org/details/monkingardenlost00heni/page/n14 1]–9 |url=https://archive.org/details/monkingardenlost00heni |url-access=registration }}</ref>。具体的には、1889年、ユーゴー・ド・フリースは著書『''Intracellular Pangenesis(''細胞内パンゲネシス)』を出版し<ref name="de_Vries_1889">{{cite book | vauthors = de Vries H | author-link1 = Hugo de Vries | title = Intracellulare Pangenese | trans-title = Intracellular Pangenesis | language = de | publisher = Verlag von Gustav Fischer | location = Jena | date = 1889 | translator-last1= Gager |translator-first1= C. Stuart |translator-link1 = C. Stuart Gager | name-list-style = vanc | url = http://www.esp.org/books/devries/pangenesis/facsimile/ }} Translated in 1908 from German to English by Open Court Publishing Co., Chicago, 1910</ref>、その中で、さまざまな性質が個別の遺伝的キャリアを持ち、生物における特定の形質の継承は粒子で行われると仮定した。ド・フリースは、ダーウィンの1868年のパンゲネシス理論にちなんで、これらの単位をパンゲネス(pangenes、{{Lang-de-short|pangens}})と呼んだ。 |
|||
遺伝子配列がわからない場合には、目的のタンパク質を対象生物内から精製し、タンパク質[[エドマン分解|N末端配列]]を決定した後、[[ミックスプライマー]](アミノ酸とその遺伝暗号に対応するパターン全てを含む複数種のプライマー、詳しくは当該記事にて)を用いてクローニングができる。 |
|||
20年後の1909年、[[ウィルヘルム・ヨハンセン]]が「遺伝子(gene)」という語句を<ref name="Johannsen" />、1906年には[[ウィリアム・ベイトソン]]が「[[遺伝学]](genetics)」という語句を導入したが<ref>{{cite book | vauthors = Bateson W | date = 1906 | chapter-url = https://www.biodiversitylibrary.org/item/206746#page/129/mode/1up | chapter = The progress of genetic research | title = Report of the Third International Conference 1906 on Genetics | veditors = Wilks W | location = London, England | publisher = Royal Horticultural Society | pages = 90–97 | quote = … the science itself [i.e. the study of the breeding and hybridisation of plants] is still nameless, and we can only describe our pursuit by cumbrous and often misleading periphrasis. To meet this difficulty I suggest for the consideration of this Congress the term ''Genetics'', which sufficiently indicates that our labors are devoted to the elucidation of the phenomena of heredity and variation: in other words, to the physiology of Descent, with implied bearing on the theoretical problems of the evolutionist and the systematist, and application to the practical problems of breeders, whether of animals or plants. }}</ref><ref name="Gerstein" />、特に[[エドゥアルト・シュトラスブルガー]]などは、依然として遺伝の基本的な物理的/機能的単位に「パンゲン(pangene)」という語句を使用していた<ref name="de_Vries_1889" /><sup>:訳者前書き(viii)</sup>。 |
|||
上記いずれのケースにおいても、単一のDNA配列のみを増幅した、あるいは精製したのみでは[[ヌクレアーゼ]]によって分解を受けてしまう。したがって、目的DNA配列をクローニングベクターに導入し、大腸菌を用いてベクターを増幅することを含めてクローニングという実験が完結する。 |
|||
=== DNAの発見 === |
|||
細菌は遺伝子に介在配列を持たないためにDNAから遺伝子をクローニングすることが可能だが、真核生物の場合は[[イントロン]]をのぞいた[[エクソン]]部分のみを抽出する必要がある。これは[[スプライシング]]後の[[mRNA]]を精製し、[[逆転写酵素|逆転写]][[ポリメラーゼ連鎖反応|PCR]] (RT-PCR) を行うことによってクローニングが可能となる。 |
|||
遺伝子と遺伝に対する理解の進歩は20世紀を通して続いた。1940年代から1950年代の実験によって、[[デオキシリボ核酸]](DNA)が遺伝情報の分子的記憶装置であることが示された<ref name="Avery_et_al">{{cite journal | vauthors = Avery OT, Macleod CM, McCarty M | title = Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types : Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated From Pneumococcus Type III | journal = The Journal of Experimental Medicine | volume = 79 | issue = 2 | pages = 137–58 | date = February 1944 | pmid = 19871359 | pmc = 2135445 | doi = 10.1084/jem.79.2.137 }} Reprint: {{cite journal | vauthors = Avery OT, MacLeod CM, McCarty M | title = Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III | journal = The Journal of Experimental Medicine | volume = 149 | issue = 2 | pages = 297–326 | date = February 1979 | pmid = 33226 | pmc = 2184805 | doi = 10.1084/jem.149.2.297 }}</ref><ref>{{cite journal | vauthors = Hershey AD, Chase M | title = Independent functions of viral protein and nucleic acid in growth of bacteriophage | journal = The Journal of General Physiology | volume = 36 | issue = 1 | pages = 39–56 | date = May 1952 | pmid = 12981234 | pmc = 2147348 | doi = 10.1085/jgp.36.1.39 }}</ref>。DNAの構造は、[[ロザリンド・フランクリン]]と[[モーリス・ウィルキンス]]によって[[X線結晶構造解析|X線結晶学]]を使用して研究され、そのことが、[[ジェームズ・ワトソン]]と[[フランシス・クリック]]が、対になった[[核酸塩基]]による遺伝子複製の機構について説得力のある仮説を示す二本鎖DNA分子モデルを発表するきっかけとなった<ref>{{cite book |title=The Eighth Day of Creation: Makers of the Revolution in Biology | vauthors = Judson H |author-link=Horace Freeland Judson |year=1979 |publisher=Cold Spring Harbor Laboratory Press |isbn=978-0-87969-477-7 |pages=51–169}}</ref><ref name="watsoncrick_1953a">{{cite journal | vauthors = Watson JD, Crick FH | title = Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid | journal = Nature | volume = 171 | issue = 4356 | pages = 737–8 | date = April 1953 | pmid = 13054692 | doi = 10.1038/171737a0 | url = http://www.nature.com/nature/dna50/watsoncrick.pdf | s2cid = 4253007 | bibcode = 1953Natur.171..737W }}</ref>。 |
|||
{{main|クローニング}} |
|||
1950年代初期、染色体内の遺伝子に対する一般的な見解は、糸で繋がれたビーズのように配置された別個の要素のように機能するというものであった。{{Ill2|T4 rII系|en|T4 rII system|label=バクテリオファージT4のrII領域}}に欠損を持つ変異体を用いた[[シーモア・ベンザー|ベンザー]]の実験(1955-1959)は、個々の遺伝子が単純な直線構造を持ち、DNAの直線部分に相当する可能性が高いことを示した<ref name="pmid16589677">{{cite journal | vauthors = Benzer S | title = Fine Structure of a Genetic Region in Bacteriophage | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 41 | issue = 6 | pages = 344–54 | date = June 1955 | pmid = 16589677 | pmc = 528093 | doi = 10.1073/pnas.41.6.344 | bibcode = 1955PNAS...41..344B | doi-access = free }}</ref><ref name="pmid16590553">{{cite journal | vauthors = Benzer S | title = On the Topology of the Genetic Fine Structure | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 45 | issue = 11 | pages = 1607–20 | date = November 1959 | pmid = 16590553 | pmc = 222769 | doi = 10.1073/pnas.45.11.1607 | bibcode = 1959PNAS...45.1607B | doi-access = free }}</ref>。 |
|||
=== シークエンシング === |
|||
{{main|DNAシークエンシング}} |
|||
この一連の研究により、[[タンパク質]]はDNAから転写されたRNAから翻訳されるという[[セントラルドグマ|分子生物学におけるセントラル・ドグマ]]が確立された。その後、この定説には[[レトロウイルス]]における[[逆転写酵素|逆転写]]{{Enlink|Reverse transcriptase#Process of reverse transcription or retrotranscription|英語版|en}}のような例外があることが示されている。DNAレベルでの[[遺伝学]]の現代的研究は、[[分子遺伝学]]と呼ばれている。 |
|||
シークエンシングとはDNAの塩基配列の並びを決定する実験を意味する。シークエンシングを行うには、やはりある程度の配列が判明している必要があるが、クローニングが可能であれば特に問題はない。シークエンシングにはかつて[[マクサム - ギルバート法]]が用いられていたが、現在はサンガー - クルソン法([[ジデオキシヌクレオチド鎖終結法]])の変法である『ダイターミネーターサイクルシークエンシング法』が一般的である。 |
|||
1972年、{{Ill2|ウォルター・ファイヤーズ|en|Walter Fiers}}と彼のチームは、[[バクテリオファージMS2]]のコートタンパク質の遺伝子配列を初めて決定した<ref name="Min_1972">{{cite journal | vauthors = Min Jou W, Haegeman G, Ysebaert M, Fiers W | title = Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein | journal = Nature | volume = 237 | issue = 5350 | pages = 82–8 | date = May 1972 | pmid = 4555447 | doi = 10.1038/237082a0 | s2cid = 4153893 | bibcode = 1972Natur.237...82J }}</ref>。その後、1977年に、[[フレデリック・サンガー]]によって鎖終結[[DNAシークエンシング]]({{Ill2|サンガー・シークエンシング|en|Sanger sequencing|label=サンガー法}})が開発され、配列決定の効率を向上させる日常的な実験ツールになった<ref name="sanger_et_al">{{cite journal | vauthors = Sanger F, Nicklen S, Coulson AR | title = DNA sequencing with chain-terminating inhibitors | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 74 | issue = 12 | pages = 5463–7 | date = December 1977 | pmid = 271968 | pmc = 431765 | doi = 10.1073/pnas.74.12.5463 | bibcode = 1977PNAS...74.5463S | doi-access = free }}</ref>。サンガー法の自動化バージョンは、[[ヒトゲノム計画]]の初期段階で使用された<ref name="scitable_adams">{{cite journal| vauthors = Adams JU |title=DNA Sequencing Technologies |url=http://www.nature.com/scitable/topicpage/dna-sequencing-technologies-690 |journal=Nature Education Knowledge |date=2008 |volume=1 |issue=1 |page=193 |series=SciTable |publisher=Nature Publishing Group}}</ref>。 |
|||
2009年現在もっとも一般的に使われているシークエンシング技術では、1つの[[プライマー]]から1,200塩基対の配列が一回の実験で決定可能である。しかし「次世代型シーケンサー」と総称される高速解読装置が複数のメーカーから発表されており、これらを用いれば従来よりはるかに大量の配列情報を短時間に得ることができる。たとえばアプライドバイオシステムズ社のSolidシステムでは一回の解析で30億塩基対の解読が可能という<ref>[http://www.natureasia.com/japan/advertising/advertorial/pdf/2007_NatureJapan_Advertorial.pdf 森下真一、橋本 真一 「日本オリジナルの遺伝子解析法と次世代シーケンサの出会いは新しい知見をもたらす」Nature 日本版 Advertising Supplement 2007]</ref>。 |
|||
=== 現代的総合とその後継者たち === |
|||
=== 過剰発現 === |
|||
{{main|{{ill2|現代的総合 (20世紀)|en|Modern synthesis (20th century)}}}} |
|||
タンパク質を用いた実験を行うには、 |
|||
[[メンデル遺伝学]]と[[ダーウィニズム|ダーウィン進化論]]を統合するために20世紀初頭に開発された理論は、[[ジュリアン・ハクスリー]]によって導入された用語で{{ill2|現代的総合 (20世紀)|en|Modern synthesis (20th century)|label=現代的総合}}({{Lang-en-short|modern synthesis}})と呼ばれている<ref>{{cite book | vauthors = Huxley J |title=Evolution: the Modern Synthesis |date=1942 |publisher=MIT Press |location=Cambridge, Massachusetts |isbn=978-0262513661}}</ref>。 |
|||
* 生物内からタンパク質を精製する、 |
|||
* '''[[過剰発現系]]'''(かじょうはつげんけい)を用いて大腸菌等ベクターの宿主に目的タンパク質を大量に発現させる |
|||
このような進化観は、[[ジョージ・クリストファー・ウィリアムズ|ジョージ・C・ウィリアムズ]]の{{Ill2|遺伝子中心の進化観|en|Gene-centered view of evolution}}によって強調された。彼は、メンデル遺伝子を「認識できる頻度で分離し、組み換わるもの」と定義し、それは[[自然選択説|自然選択]]の{{Ill2|選択単位|en|Unit of selection}}(生物学的組織の階層における生物学的実体)であると提案した<ref>{{cite book | vauthors = Williams GC |title=Adaptation and Natural Selection a Critique of Some Current Evolutionary Thought |date=2001 |publisher=Princeton University Press |location=Princeton |isbn=9781400820108 |edition=Online}}</ref>{{rp|24}}。メンデル遺伝子の中心性と進化における自然選択の重要性を強調する関連した考えは、[[リチャード・ドーキンス]]によって広められた<ref name="Dawkins_2018" />。 |
|||
という二通りの方法がある。生物内からタンパク質を精製するには、大量のサンプルが必要であり、[[タンパク質の精製|タンパク質精製]]のテクニックが必要であるために一般的な技術とは言いがたい。一方過剰発現系を用いれば、誰でも簡単に目的のタンパク質を大量に得ることができる。 |
|||
1960年代後半に[[中立説|進化中立説]]が発展したことで、無作為な遺伝的浮動が進化における主要な担い手であり、中立説は分子進化の[[帰無仮説]]とあるべきという認識につながった<ref>{{cite journal | vauthors = Duret L | date = 2008 | title = Neutral Theory: The Null Hypothesis of Molecular Evolution | journal = Nature Education | volume = 1 | pages = 218 | url = https://www.nature.com/scitable/topicpage/neutral-theory-the-null-hypothesis-of-molecular-839/ }}</ref>。これが[[系統樹]]の構築と、DNA配列を使用したすべての[[年代測定]]技術の基礎となる[[分子時計]]の開発につながった。これらの技術は分子遺伝子の配列に限定されるものではなく、ゲノムのすべてのDNAセグメントに適用することができる。 |
|||
最も一般的な過剰発現系には、発現ベクター中の大腸菌の[[lacZ|''lac''Z]]プロモーター配列の下流に、クローニングした遺伝子を導入する方法がある。この方法では、[[IPTG]]という物質を用いて''lacZ''プロモーター下流の遺伝子を大腸菌内で発現させることができる。転写されたmRNAはその後、大腸菌の[[リボソーム]]で翻訳され、大量にタンパク質を生産する。 |
|||
== 分子基盤 == |
|||
このようにして生産したタンパク質を用いて、[[酵素]]であれば活性を測定したり、DNA結合タンパクであればDNA結合実験を行ったりとタンパク質の実験が可能である。現在、ポストゲノムと言われる分野の主流はこの過剰発現系を用いたものである。しかしながら、大腸菌発現系では多くの問題を抱えており、現在大腸菌以外にも多くの発現宿主が開発されている(細菌:細胞外酵素作成型([[Bacillus属|''Bacillus''属]]を用いたもの)真核生物:[[出芽酵母]]、動物細胞、ヒト細胞などなど)。 |
|||
{{Main|[[デオキシリボ核酸|デオキシリボ核酸 (DNA)]]}} |
|||
{{main|過剰発現系}} |
|||
[[File:DNA chemical structure 2.svg|thumb|upright=1.5|[[デオキシリボ核酸|DNA]]の{{Ill2|核酸二重らせん|en|Nucleic acid double helix|label=二重らせん}}の4塩基対断片の化学構造。[[デオキシリボース|糖]]-[[リン酸塩|リン酸]]主鎖は[[核酸塩基|塩基]]を内側にして互いに反対方向に走り、[[アデニン|A]]と[[チミン|T]]、[[シトシン|C]]と[[グアニン|G]]が[[水素結合]]で[[塩基対]]を形成している。|alt=DNA chemical structure diagram showing how the double helix consists of two chains of sugar-phosphate backbone with bases pointing inwards and specifically base pairing A to T and C to G with hydrogen bonds.]] |
|||
=== DNA === |
|||
以上のような方法と比較して、要するコスト及び時間を低下させることが可能な、コムギ胚芽を利用した[[無細胞タンパク質合成系]]という新たな方法も研究されている。 |
|||
大半の生物は、[[デオキシリボ核酸|DNA]](デオキシリボ核酸)の長い[[重合体|鎖]]にその遺伝子を[[遺伝コード|コード化]](符号化)している。DNAは、4種類の[[ヌクレオチド]]サブユニットからなる鎖で構成されており、それぞれのサブユニットは、五炭糖([[デオキシリボース|2-デオキシリボース]])、[[リン酸塩|リン酸]]基、そして[[アデニン]]、[[シトシン]]、[[グアニン]]、[[チミン]]の4[[核酸塩基|塩基]]のうちの1つから構成されている<ref name="MBOC">{{cite book | vauthors = Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P | author1-link = Bruce Alberts | author3-link = Julian Lewis (biologist) | author4-link = Martin Raff | author6-link = Peter Walter | title = Molecular Biology of the Cell | edition = Fourth | publisher = Garland Science | location = New York | year = 2002 | isbn = 978-0-8153-3218-3 | url = https://www.ncbi.nlm.nih.gov/books/NBK21054/}}</ref>{{rp|2.1}}。 |
|||
DNAの2本の鎖が互いにねじり合わさってDNA{{Ill2|核酸二重らせん|en|Nucleic acid double helix|label=二重らせん}}を形成し、リン酸-糖[[主鎖]]が外側をらせん状に回り、塩基は内側に向いてアデニンはチミンと、グアニンはシトシンと[[塩基対]]をなしている。塩基対形成による特異性は、アデニンとチミンが2本の[[水素結合]]を形成するのに対し、シトシンとグアニンは3本の水素結合を形成することから生じる。したがって、二重らせんの2本の鎖は[[相補性 (分子生物学)|相補的]]でなければならず、一方の鎖のアデニンともう一方の鎖のチミンが対になるように、またグアニンとシトシンも同様に、塩基の配列が一致していなければならない{{rp|4.1}}<ref name="MBOC" />。 |
|||
=== 遺伝子研究の応用 === |
|||
[[遺伝子導入]]とは、上記にあげた遺伝子の実験系を用いて目的遺伝子の宿主でない他生物にクローニングしたベクターを導入し、その遺伝子が有効な形質を発現できるように仕向けることである。例えば、特定の[[除草剤]]に対して耐性を持つような作物や、[[霜害]]を防ぐ糖タンパクを生産できる作物(アイスマイナス)などはその一例である。 |
|||
塩基の[[ペントース]]残基の化学組成に起因して、DNA鎖には[[方向性 (分子生物学)|方向性]]が生じる。DNA[[重合体|ポリマー]]の一端には、[[デオキシリボース]]上に露出した[[ヒドロキシ基]]があり、これは分子の[[3'末端]]と呼ばれている。もう一方の末端には露出した[[リン酸塩|リン酸]]基があり、これは[[5'末端]]と呼ばれる。二重らせんの2本の鎖は反対方向に走っている。[[DNA複製|DNAの複製]]や[[転写 (生物学)|転写]]を含む核酸合成は5'→3'方向に行われるが、その理由は、露出した3'-ヒドロキシを[[求核剤]]とした[[脱水反応]]によって新しいヌクレオチドが付加されるからである<ref name="Stryer_2002">{{cite book |vauthors=Stryer L, Berg JM, Tymoczko JL | title = Biochemistry | publisher = W.H. Freeman | location = San Francisco | year = 2002 | edition = 5th | isbn = 978-0-7167-4955-4 | url = https://www.ncbi.nlm.nih.gov/books/NBK21154/ }}</ref>{{rp|27.2}}。 |
|||
しかしながら、導入したベクターが[[花粉]]などを通じて拡散し、除草剤耐性を持っていなかった雑草にまでそうした形質が導入される危険性を指摘され、このような遺伝子組み換え実験は厳しく規制された状況である。遺伝子組み換え実験による物理的規制は |
|||
DNAにコードされた[[遺伝子発現|遺伝子の発現]]は、遺伝子をRNAに[[転写 (生物学)|転写]]することから始まる。[[リボ核酸|RNA]]はDNAと非常によく似た構造を持っている第二の核酸であるが、そのモノマーは[[デオキシリボース]]ではなく[[リボース]]糖を含んでいる。また、RNAには、[[チミン]]の代わりに[[ウラシル]]塩基も含まれている。RNA分子はDNAよりも安定性が低く、一般的に一本鎖で存在する。タンパク質をコードする遺伝子は、[[コドン]]と呼ばれる3連の[[ヌクレオチド]]配列で構成されており、遺伝子の「言語」における「単語」として役割を果たす。[[遺伝情報|遺伝暗号]]は、[[翻訳 (生物学)|タンパク質が翻訳]]される際のコドンと[[アミノ酸]]との対応関係を規定する。遺伝暗号はすべての既知の生物でほぼ同じである<ref name="MBOC" />{{rp|4.1}}。 |
|||
* P1:一般的な実験室 |
|||
* P2:病原性を扱うような実験室 |
|||
* P3:バイオクリーンルーム(室内に流入する空気は全て[[HEPA|HEPAフィルタ]](0.22μm方形のフィルター)を通している) |
|||
* P4:遺伝子組み換え対象生物に触れずに実験できる実験室 |
|||
=== 染色体 === |
|||
というランクが付けられており、危険な遺伝子組み換え実験を行う場合にはそれ相応の規制のランクの敷かれた実験室で行うよう義務付けられている。 |
|||
[[File:NHGRI human male karyotype.png|thumb|ヒト男性の23対の[[染色体]]を示す{{Ill2|顕微鏡写真|en|Micrograph}}による[[核型|カリオグラム]]。大きさは最大と最小で約10倍の開きがある<ref>{{cite journal | vauthors = Bolzer A, Kreth G, Solovei I, Koehler D, Saracoglu K, Fauth C, Müller S, Eils R, Cremer C, Speicher MR, Cremer T | display-authors = 6 | title = Three-dimensional maps of all chromosomes in human male fibroblast nuclei and prometaphase rosettes | journal = PLOS Biology | volume = 3 | issue = 5 | pages = e157 | date = May 2005 | pmid = 15839726 | pmc = 1084335 | doi = 10.1371/journal.pbio.0030157 | doi-access = free }} {{open access}}</ref>。]] |
|||
[[File:Human karyotype with bands and sub-bands.png|thumb|ヒトの模式的[[カリオグラム]]で、注釈付きの[[遺伝子座|バンドとサブバンド]]を含む。[[G分染法|Gバンディング]]上に濃い部分と薄い部分が見られる。22本の[[相同染色体]]の他、男性 (XY) と女性 (XX) の性染色体 (右下)、{{Ill2|ヒトミトコンドリア遺伝学|en|Human mitochondrial genetics|label=ミトコンドリアゲノム}} (左下) を示す。 {{further|核型<!-- Karyotype -->}}]] |
|||
生物体または細胞内の遺伝子の総体を[[ゲノム]]といい、1本または複数の[[染色体]]に保存することができる。染色体は、単一の非常に長いDNAらせんで、その内部には数千もの遺伝子がコード化されている<ref name="MBOC" />{{rp|4.2}}。特定の遺伝子が存在する染色体の領域を[[遺伝子座|座位]](または遺伝子座)と呼ぶ。各座位には遺伝子の[[アレル]]({{Lang-en-short|allele}}、対立遺伝子)が1つずつ存在するが、集団のメンバーの中にはその座位に異なるアレルが存在し、遺伝子の配列がわずかに異なる場合がある。 |
|||
なお、遺伝子組み換えの規制に関して、1975年、アメリカで開かれたアシロマ会議において基本的なガイドラインが決められた。遺伝子組み換えによって誕生した生物の取り扱いについては、2003年、生物の多様性に関する条約としてカルタヘナ議定書が締結された。 |
|||
[[真核生物]]の遺伝子の大部分は、一連の大きな線状染色体に保存されている。染色体は、[[ヒストン]]と呼ばれる貯蔵タンパク質と複合体となって[[細胞核|核内]]に詰め込まれ、[[ヌクレオソーム]]と呼ばれる単位を形成する。このようにパッケージ化されて凝縮したDNAは[[クロマチン]]と呼ばれる<ref name="MBOC" />{{rp|4.2}}。DNAがヒストン上に保存される方法や、ヒストン自体の化学的修飾によって、DNAの特定の領域が[[遺伝子発現]]に利用可能かどうかが調節される。遺伝子に加えて、真核生物の染色体には、細胞分裂の際にDNAが末端領域を分解することなく複製され、娘細胞に確実に振り分けられるようにするための配列、すなわち[[複製起点]]、[[テロメア]]、[[セントロメア]]が含まれている<ref name="MBOC" />{{rp|4.2}}。複製起点は、染色体の2つの複製を作成するために[[DNA複製]]が開始される配列領域である。テロメアは、線状染色体の末端を覆う長い反復配列で、DNA複製時にコーディング領域や調節領域の分解を防ぐ役割を担う。テロメアの長さはゲノムが複製されるたびに短縮し、[[老化]]プロセスに関与していると考えられている<ref name="Braig">{{cite journal | vauthors = Braig M, Schmitt CA | title = Oncogene-induced senescence: putting the brakes on tumor development | journal = Cancer Research | volume = 66 | issue = 6 | pages = 2881–4 | date = March 2006 | pmid = 16540631 | doi = 10.1158/0008-5472.CAN-05-4006 | doi-access = free }}</ref>。セントロメアは、[[細胞分裂]]の際に姉妹染色分体を娘細胞に分離する[[紡錘糸]]を結合するために必要である<ref name="MBOC" />{{rp|18.2}}。 |
|||
== 歴史 == |
|||
現在の遺伝子の概念は[[グレゴール・ヨハン・メンデル|メンデル]]によって定義される。彼はエンドウのいくつかの[[表現型]]に注目した交雑実験を行い、表現形質が分離することを発見する(1865年 →[[メンデルの法則]])。これを説明するために形質を伝える因子たる「遺伝粒子」を考え、これが現在の遺伝子の基となっている。それまで形質は液体のように混じりあっていくと考えられていた。しかし、長らくメンデルの法則は不評で、1900年に再発見されるまで理解されなかった。<ref>『フォトサイエンス生物図録』視覚でとらえる142頁~143頁</ref> |
|||
[[原核生物]]([[細菌]]と[[古細菌]])は通常、一本の大きな[[DNA超らせん|環状染色体]]にゲノムを格納している。同様に、真核生物の[[細胞小器官]]の中には、少数の遺伝子を含む残余の環状染色体を持つものもある<ref name="MBOC" />{{rp|14.4}}。原核生物は、[[プラスミド]]と呼ばれる小さな環状DNAで染色体を補うことがある。プラスミドは通常、少数の遺伝子しかコードしておらず、個体間で転移可能である。たとえば、[[抗生物質耐性]]の遺伝子は通常、細菌のプラスミド上にコードされており、[[遺伝子の水平伝播]]によって、(たとえ異なる種の細胞間であっても)個々の細胞間で受け継ぐことができる<ref name="bennett">{{cite journal | vauthors = Bennett PM | title = Plasmid encoded antibiotic resistance: acquisition and transfer of antibiotic resistance genes in bacteria | journal = British Journal of Pharmacology | volume = 153 | issue = Suppl 1 | pages = S347-57 | date = March 2008 | pmid = 18193080 | pmc = 2268074 | doi = 10.1038/sj.bjp.0707607 }}</ref>。<!-- 異なる定義の下での「ジャンク%」の表か何かが必要だろう。80%という表現では、生物学的な関連性についての文脈を読者に与えることはできない。 --> |
|||
細胞学者たちは減数分裂の様子を観察し、対になった染色体が一つずつになり、接合後に再び対を作るという染色体の挙動が、遺伝子のそれと同じであることを発見した(→[[染色体説]])。[[ショウジョウバエ]]の[[突然変異]]を用いた遺伝学的実験によりそれが明らかにされた。<ref>『フォトサイエンス生物図録』視覚でとらえる144頁~145頁</ref> |
|||
原核生物の染色体が比較的、遺伝子密度が高いのに対し、真核生物の染色体は明らかな機能を持たないDNA領域を含むことがよくある。単細胞の単純な真核生物にはこのようなDNAは比較的少ないが、ヒトを含む複雑な[[多細胞生物]]のゲノムには、機能が特定されていないDNAが絶対的に多く含まれている<ref name="IHSGC2004">{{cite journal | author = International Human Genome Sequencing Consortium | title = Finishing the euchromatic sequence of the human genome | journal = Nature | volume = 431 | issue = 7011 | pages = 931–45 | date = October 2004 | pmid = 15496913 | doi = 10.1038/nature03001 | doi-access = free | bibcode = 2004Natur.431..931H }}</ref>。このDNAはしばしば「[[ジャンクDNA]]」と呼ばれてきた。しかし、より最近の分析によると、タンパク質をコードするDNAは[[ヒトゲノム]]の2%を占めるに過ぎないものの、ゲノム中の塩基の約80%が発現している可能性があるため、ジャンクDNAという言葉は誤用である可能性が示唆されている<ref name="Rethink">{{cite journal | vauthors = Pennisi E | author-link = Elizabeth Pennisi | title = Genomics. DNA study forces rethink of what it means to be a gene | journal = Science | volume = 316 | issue = 5831 | pages = 1556–7 | date = June 2007 | pmid = 17569836 | doi = 10.1126/science.316.5831.1556 | s2cid = 36463252 | doi-access = free }}</ref>。 |
|||
染色体はタンパク質と核酸からできていることが明らかにされたが、当時はタンパク質が遺伝子の正体であると考えられていた。多数の種類があるタンパク質に比べ、核酸はあまりにも多様性が低いと考えられていたためである。実際、100bpのDNAの情報量は約10の60乗 (4<sup>100</sup>) であるのに対し、100個のアミノ酸で構成される蛋白質の情報量は10の130乗 (20<sup>100</sup> = 2<sup>100</sup> × 10<sup>100</sup>) と甚だ差が激しい。 |
|||
== 構造と機能 == |
|||
しかし、肺炎双球菌やファージを用いた実験で DNA が遺伝子の正体であることが実証され、そのすぐ後に DNA の構造が解明された。DNA の二重らせん構造は遺伝子の性質と非常によく一致していた。 |
|||
<!-- 注意: 以下の遺伝子構造画像テンプレートは、モバイルやタブレット画面で適切にスクロールするように1x1の表になっています (2015年現在) --> |
|||
=== メンデルの法則発見から二重らせん構造発見までの歴史 === |
|||
* [[1865年]] [[グレゴール・ヨハン・メンデル]]がエンドウの交雑実験の結果を発表。(→[[メンデルの法則]]) |
|||
* [[1869年]] [[フリードリッヒ・ミーシェル]]が膿の細胞抽出液から[[デオキシリボ核酸|DNA]]を発見する。 |
|||
* [[1900年]] メンデルの投稿した論文が[[ユーゴー・ド・フリース]]([[オランダ]])、[[カール・エーリヒ・コレンス]]([[ドイツ]])、[[エーリヒ・フォン・チェルマク]]([[オーストリア]])によって再発見される。この再発見者の一人フリースは[[パンゲン説]]を推し、細胞内で形質を伝達する物質をパンゲンと仮定する。 |
|||
* [[1903年]] [[ウォルター・S・サットン]]がパンゲンが[[染色体]]上にあることを提唱した。(→[[染色体説]]) |
|||
* [[1909年]] [[ウィルヘルム・ヨハンセン]]はメンデルの指摘した因子をフリースの名づけたパンゲン (pangen) から『'''gene(遺伝子)'''』と呼ぶことを提案した。 |
|||
* [[1910年]] [[トーマス・ハント・モーガン]]が[[ショウジョウバエ]]の交雑実験を始める。 |
|||
* [[1921年]] DNAの[[テトラヌクレオチドモデル]]を解説した論文が発表される(J. Biol Chem. 48:119〜125)。当時、遺伝物質は多様性に富んだポリペプチド(タンパク質)であり、テトラヌクレオチドはその保護の役割を果たしていると考えられていた。 |
|||
* [[1922年]] モーガンらのグループによってショウジョウバエの4つの染色体上に座している50個の遺伝子の相対位置が決定され、発表される。 |
|||
* [[1927年]] [[ハーマン・J・マラー]]が[[X線]]は遺伝子に[[突然変異]]を導入することを指摘する。 |
|||
* [[1934年]] {{仮リンク|トルビョルン・カスペルソン|label=カスパーソン|en|Torbjörn Caspersson}}がDNAは[[生体高分子]]であることを示し、テトラヌクレオチドモデルが誤りであることが証明される。 |
|||
* [[1935年]] [[マックス・デルブリュック]]らは、遺伝子は物質的単位であることを提案した。 |
|||
* [[1941年]] [[ジョージ・ウェルズ・ビードル|ビードル]]と[[エドワード・ローリー・タータム|タータム]]が『[[一遺伝子一酵素説]]』(1つの遺伝子は1つの酵素をコードしている)を発表。 |
|||
* [[1944年]] [[フレデリック・グリフィス]]の肺炎双球菌の形質転換実験([[グリフィスの実験]])を元にした、[[オズワルド・アベリー]]らの『DNAが遺伝物質であることの実験的証明』を収めた論文が掲載される(J. Exp. Med. 79:137〜158)。この論文はDNA=遺伝物質であることが確実な今、矛盾のないものだが、当時は評価を全く受けなかった(註:この見方は、アヴェリーが属していたロックフェラー研究所およびその周辺での、当初の反響を伝えているに過ぎない。実際には、ジョシュア・レーダーバーグ、ジェームス・ワトソン、マックファーレン・バーネットなど現代遺伝学・分子生物学の元を築いた科学者たちが、「まだ初学者であった頃にアヴェリーらの論文を読んで大きな刺激を受けた」と述べている。ちなみに、ワトソンは彼の著書(ワトソン&ベリー『DNA』)のなかでも、「アヴェリーの実験はハーシーとチェイスの実験が行われる前に既に評価されていた」と重ねて記している。つまり、先を見据えていた科学者の間では正当に評価されていたということである。) |
|||
* [[1950年]] [[エルヴィン・シャルガフ]]が[[ペーパークロマトグラフィー]]を用いて塩基存在比に数学的関連があることを明らかにした(AとT、GとCはそれぞれ数が等しいことを示した)。 |
|||
* [[1952年]] [[アルフレッド・ハーシー]]と[[マーサ・チェイス]]による『[[ハーシーとチェイスの実験]]』結果が論文に掲載される(J. Gen. Physiol. 36:39〜56)。本論文によってファージの遺伝物質がDNAであることが確実視されたと言われる。同年、[[ロザリンド・フランクリン]]がDNAが[[二重らせん構造]]であることを証明するX線回折像写真を撮影する。 |
|||
* [[1953年]] [[ジェームズ・ワトソン]]と[[フランシス・クリック]]によってDNAのB型二重らせん構造のモデルが示され、DNAは生体内で『[[二重らせん構造]]』をとっていることを示す論文が発表される(Nature 171:737,738)。 |
|||
=== |
=== 構造 === |
||
{| style="clear:right; float: right;" |
|||
* [[1955年]] セベロ・オチョアによってポリヌクレオチドホスホリラーゼが発見された(一見遺伝子とは無関係だが[[遺伝暗号]]の解明に寄与した重要な[[酵素]]である) |
|||
|- |
|||
* [[1956年]] エリオット・ヴォルキンとラザルス・アストラチャンによってDNAから[[タンパク質]]への情報のメッセンジャーがRNAである証拠が提出された(mRNAが存在する可能性を示した、このことが確実になったのは5年後、ソル・シュピーゲルマンとベンジャミン・D・ホールらの実験による) |
|||
|{{Eukaryote_gene_structure}} |
|||
* [[1958年]] クリックによって[[セントラルドグマ]]が提唱された(Symp. Soc. Exp. Biol. 12:138〜163)。 |
|||
{{Prokaryote_gene_structure}} |
|||
* [[1959年]] ロバート・ホリーによって[[tRNA|tRNA<sup>ala</sup>]]分子が単離された |
|||
|} |
|||
* [[1961年]] マーシャル・ニーレンバーグとハインリッヒ・マテイによって[[大腸菌]][[無細胞発現系]]を用いたポリ[[ウラシル]]からポリ[[フェニルアラニン]]が合成される実験が行われた(遺伝暗号解明への初めての実験)。 |
|||
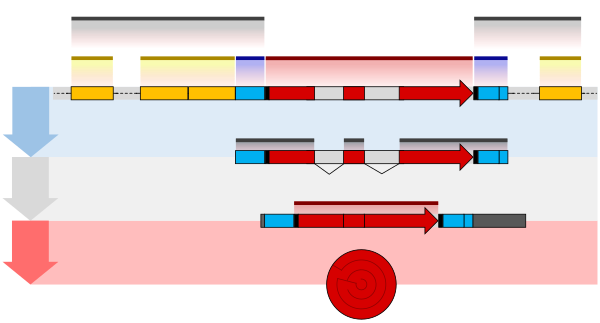
{{Ill2|遺伝子の構造|en|Gene structure|label=タンパク質コード遺伝子}}は多くの要素から構成されており、実際の[[コーディング領域|タンパク質コード配列]]は多くの場合、そのごく一部にしか過ぎない。これらには、[[成熟メッセンジャーRNA|成熟mRNA]]のイントロンや[[非翻訳領域]]が含まれる。非コード遺伝子にもイントロンが含まれることがあり、それらは機能的の成熟RNAを産生する過程で除去される。 |
|||
* [[1964年]] ニーレンバーグとフィリップ・レーダーによって遺伝暗号解明に大きな寄与をした『[[トリプレット結合能測定法]]』が開発された。ヤノフスキーによって遺伝子がタンパク質をコードしていることが示された(遺伝子タンパク質間の'''共直線性'''が示された) |
|||
* [[1966年]] 遺伝暗号の解読が完了した |
|||
すべての遺伝子は、その発現に必要な{{Ill2|調節配列|en|Regulatory sequence}}と関連付けられている。まず、遺伝子には[[プロモーター]]配列が必要である。プロモーターは[[転写因子]]によって認識・結合される。転写因子はさらに[[RNAポリメラーゼ]]を動員して、その領域に結合して転写を開始するのを助ける<ref name="MBOC" />{{rp|7.1}}。この認識は通常、[[TATAボックス]]のような[[コンセンサス配列]]として行われる。遺伝子は複数のプロモーターを持つことができ、その結果、5'末端の長さが異なる[[メッセンジャーRNA]](mRNA)が生成する<ref>{{cite journal | vauthors = Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B | title = Mapping and quantifying mammalian transcriptomes by RNA-Seq | journal = Nature Methods | volume = 5 | issue = 7 | pages = 621–8 | date = July 2008 | pmid = 18516045 | doi = 10.1038/nmeth.1226 | s2cid = 205418589 }}</ref>。高度転写遺伝子<!-- Highly transcribed genes, 高度に転写された遺伝子? -->は、転写因子と強い結合を形成する「強い」プロモーター配列があり、それによって転写が高速に開始される。他の遺伝子は、転写因子との結合が弱く、転写を開始する頻度が低い「弱い」プロモーターを持っている<ref name="MBOC" />{{rp|7.2}}。[[真核生物]]のプロモーター領域は、[[原核生物]]のプロモーターよりもはるかに複雑で、同定するのは難しい<ref name="MBOC" />{{rp|7.3}}。 |
|||
* [[1970年]] ハワード・テミンとデビット・バルチモアがそれぞれある種の[[ウイルス]]で[[逆転写酵素|逆転写]]反応を見出した(セントラルドグマ概念の訂正) |
|||
* [[1977年]] 遺伝子が介在配列によっていくつかの単位に分断されていることが発見された(不連続遺伝子、[[イントロン]]の発見) |
|||
さらに遺伝子は、発現を変化させる調節領域が、その遺伝子の何1,000塩基も上流または下流に存在することがある。これらの領域は転写因子と{{Ill2|DNA結合部位|en|DNA binding site|label=結合}}することによって作用し、DNAをループさせて、調節配列(および結合した転写因子)がRNAポリメラーゼ結合部位に近づくようにする<ref name="5questions">{{cite journal | vauthors = Pennacchio LA, Bickmore W, Dean A, Nobrega MA, Bejerano G | title = Enhancers: five essential questions | journal = Nature Reviews. Genetics | volume = 14 | issue = 4 | pages = 288–95 | date = April 2013 | pmid = 23503198 | pmc = 4445073 | doi = 10.1038/nrg3458 }}</ref>。たとえば、[[エンハンサー]]は[[アクチベーター]]タンパク質と結合することで転写を増加させ、RNAポリメラーゼをプロモーターに動員するのを助ける。逆に[[サイレンサー (遺伝学)|サイレンサー]]は[[リプレッサー]]タンパク質と結合し、DNAがRNAポリメラーゼに利用されにくくする<ref>{{cite journal | vauthors = Maston GA, Evans SK, Green MR | title = Transcriptional regulatory elements in the human genome | journal = Annual Review of Genomics and Human Genetics | volume = 7 | pages = 29–59 | year = 2006 | pmid = 16719718 | doi = 10.1146/annurev.genom.7.080505.115623 | doi-access = free }}</ref>。 |
|||
* [[1979年]] [[フレデリック・サンガー]]によって[[ミトコンドリア]]ではことなる遺伝暗号が使用されていることが発見された([[非標準コドン]]の発見) |
|||
* [[1981年]] [[トーマス・チェック]]によって自己[[スプライシング]]イントロンが発見された([[リボザイム]]の発見) |
|||
タンパク質コード遺伝子から産生される成熟メッセンジャーRNAの両端には、[[リボソーム]]、[[RNA結合タンパク質]]、[[miRNA|マイクロRNA]]、[[ターミネーター (遺伝学)|ターミネーター]]、[[開始コドン|開始]]・[[終止コドン]]などの結合部位を含む[[非翻訳領域]]がある<ref>{{cite journal | vauthors = Mignone F, Gissi C, Liuni S, Pesole G | title = Untranslated regions of mRNAs | journal = Genome Biology | volume = 3 | issue = 3 | pages = REVIEWS0004 | date = 2002-02-28 | pmid = 11897027 | pmc = 139023 | doi = 10.1186/gb-2002-3-3-reviews0004 | doi-access = free }}</ref>。さらに、ほとんどの真核生物の[[オープンリーディングフレーム]]には、[[RNAスプライシング]]という過程で除去される非翻訳[[イントロン]]と、一緒に連結される[[エクソン]]が含まれている。最後に、遺伝子転写産物の末端が[[ポリアデニル化|切断およびポリアデニル化(CPA)部位]]によって規定され、そこで新たに生成された[[pre-mRNA]]が切断され、約200個のアデノシン一リン酸が3'末端に付加される。[[ポリ(A)テール]]は[[成熟メッセンジャーRNA|成熟mRNA]]を分解から保護し、翻訳、局在化、および核からの転写物の輸送に影響する役割を持つ。スプライシングと、それに続くポリアデニル化により、タンパク質またはRNA産物をコードする最終的な成熟mRNAが生成する<ref>{{cite journal | vauthors = Bicknell AA, Cenik C, Chua HN, Roth FP, Moore MJ | title = Introns in UTRs: why we should stop ignoring them | journal = BioEssays | volume = 34 | issue = 12 | pages = 1025–34 | date = December 2012 | pmid = 23108796 | doi = 10.1002/bies.201200073 | s2cid = 5808466 | doi-access = free }}</ref>。ヒト遺伝子の位置を決定する一般的な機構は知られているが、これらの細胞プロセスを調節する正確な因子を同定することは、活発な研究分野である。たとえば、[[3' 非翻訳領域|3'-UTR]]における既知の配列特徴では、ヒト遺伝子末端の半分しか説明できない<ref>{{cite journal | vauthors = Shkurin A, Pour SE, Hughes TR | title = Known sequence features explain half of all human gene ends | journal = NAR Genomics and Bioinformatics | volume = 5 | issue = 2 | pages = lqad031 | date = April 2023 | pmid = 37035540 | pmc = 10072996 | doi = 10.1093/nargab/lqad031 }}</ref>。 |
|||
真核生物の非コード遺伝子の多くは、異なる転写終結機構を持ち、ポリ(A)テールを持たない。 |
|||
原核生物の遺伝子の多くは、いくつかのタンパク質コード遺伝子が一団として転写される[[オペロン]]に組織化されている<ref>{{cite journal | vauthors = Salgado H, Moreno-Hagelsieb G, Smith TF, Collado-Vides J | title = Operons in Escherichia coli: genomic analyses and predictions | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 97 | issue = 12 | pages = 6652–7 | date = June 2000 | pmid = 10823905 | pmc = 18690 | doi = 10.1073/pnas.110147297 | bibcode = 2000PNAS...97.6652S | doi-access = free }}</ref><ref>{{cite journal | vauthors = Blumenthal T | title = Operons in eukaryotes | journal = Briefings in Functional Genomics & Proteomics | volume = 3 | issue = 3 | pages = 199–211 | date = November 2004 | pmid = 15642184 | doi = 10.1093/bfgp/3.3.199 | doi-access = free }}</ref>。オペロン内の遺伝子は、[[伝令RNA#モノシストロン型とポリシストロン型の違い|ポリシストロン型mRNA]]と呼ばれる連続したメッセンジャーRNAとして転写される。この文脈での{{Ill2|シストロン (遺伝学)|en|Cistron|label=シストロン}}という用語は遺伝子に相当する。オペロンのmRNAへの転写は、多くの場合、特定の代謝産物の存在によって活性化または不活性する[[リプレッサー]]によって制御される<ref name="pmid13718526">{{cite journal | vauthors = Jacob F, Monod J | title = Genetic regulatory mechanisms in the synthesis of proteins | journal = Journal of Molecular Biology | volume = 3 | issue = 3 | pages = 318–56 | date = June 1961 | pmid = 13718526 | doi = 10.1016/S0022-2836(61)80072-7 | s2cid = 19804795 }}</ref>。リプレッサーが活性化すると、[[オペロン#一般的構造|オペレーター領域]]と呼ばれる[[オペロン]]の先頭にあるDNA配列に結合し、オペロンの[[転写 (生物学)|転写]]を抑制する。逆にリプレッサーが不活性化した場合、オペロンの転写を起こすことができるようになる(たとえば、[[ラクトースオペロン|''lac''オペロン]]を参照)。オペロン遺伝子の産物は通常、関連した機能を持ち、同じ{{Ill2|遺伝子制御ネットワーク|en|Gene regulatory network|label=}}に関与している<ref name="MBOC" />{{rp|7.3}}。 |
|||
=== 複雑性 === |
|||
多くの遺伝子は単純な構造を持っているが、生物学の多くと同様に、非常に複雑な構造をしていたり、珍しい極端な例を示すものもある。真核生物の遺伝子は、しばしばエクソンよりもはるかに大きなイントロンを持ち<ref>{{cite journal | vauthors = Pozzoli U, Menozzi G, Comi GP, Cagliani R, Bresolin N, Sironi M | title = Intron size in mammals: complexity comes to terms with economy | journal = Trends in Genetics | volume = 23 | issue = 1 | pages = 20–24 | date = January 2007 | pmid = 17070957 | doi = 10.1016/j.tig.2006.10.003 }}</ref><ref>{{cite journal | vauthors = Marais G, Nouvellet P, Keightley PD, Charlesworth B | title = Intron size and exon evolution in Drosophila | journal = Genetics | volume = 170 | issue = 1 | pages = 481–485 | date = May 2005 | pmid = 15781704 | pmc = 1449718 | doi = 10.1534/genetics.104.037333 }}</ref>、これらのイントロンは{{Ill2|入れ子遺伝子|en|Nested gene|label=他の遺伝子を内包}}することさえある<ref name="Kumar">{{cite journal | vauthors = Kumar A | title = An overview of nested genes in eukaryotic genomes | journal = Eukaryotic Cell | volume = 8 | issue = 9 | pages = 1321–1329 | date = September 2009 | pmid = 19542305 | pmc = 2747821 | doi = 10.1128/EC.00143-09 }}.</ref>。関連するエンハンサーは、何1,000塩基も離れていたり、あるいは、2つの染色体間の物理的接触を介して作用する、まったく別の染色体上に存在することさえある<ref>{{cite journal | vauthors = Spilianakis CG, Lalioti MD, Town T, Lee GR, Flavell RA | title = Interchromosomal associations between alternatively expressed loci | journal = Nature | volume = 435 | issue = 7042 | pages = 637–645 | date = June 2005 | pmid = 15880101 | doi = 10.1038/nature03574 | bibcode = 2005Natur.435..637S | s2cid = 1755326 }}</ref><ref>{{cite journal | vauthors = Williams A, Spilianakis CG, Flavell RA | title = Interchromosomal association and gene regulation in trans | journal = Trends in Genetics | volume = 26 | issue = 4 | pages = 188–197 | date = April 2010 | pmid = 20236724 | pmc = 2865229 | doi = 10.1016/j.tig.2010.01.007 }}</ref>。一つの遺伝子が[[選択的スプライシング]]によって複数の異なる機能的産物をコードすることもできるし、逆に一つの遺伝子が染色体間をまたがって分割しても、それらの転写産物は[[トランススプライシング]]によって再び機能的配列に連結される<ref name="Lei2016">{{cite journal | vauthors = Lei Q, Li C, Zuo Z, Huang C, Cheng H, Zhou R | title = Evolutionary Insights into RNA trans-Splicing in Vertebrates | journal = Genome Biology and Evolution | volume = 8 | issue = 3 | pages = 562–577 | date = March 2016 | pmid = 26966239 | pmc = 4824033 | doi = 10.1093/gbe/evw025 }}</ref>。また、{{Ill2|オーバーラップ遺伝子|en|Overlapping gene|label=}}が、DNA配列の一部を、反対側の鎖上または同じ鎖上(異なるリーディングフレーム、あるいは同じリーディングフレーム)で共有することも可能である<ref name="Wright_2021">{{cite journal | vauthors = Wright BW, Molloy MP, Jaschke PR | title = Overlapping genes in natural and engineered genomes | journal = Nature Reviews. Genetics | volume = 23 | issue = 3 | pages = 154–168 | date = March 2022 | pmid = 34611352 | pmc = 8490965 | doi = 10.1038/s41576-021-00417-w }}</ref>。 |
|||
== 遺伝子発現 == |
|||
{{main|遺伝子発現<!-- Gene expression -->}} |
|||
すべての生物において、遺伝子のDNAに[[遺伝コード|コード]]された情報を読み取り、それによって規定されるタンパク質を生成するためには、2つの段階を経る必要がある。まず、遺伝子のDNAが[[メッセンジャーRNA]](mRNA)に[[転写 (生物学)|転写]]される<ref name="MBOC" />{{rp|6.1}}。次に<sub>、</sub>そのmRNAがタンパク質に[[翻訳 (生物学)|翻訳]]される<ref name="MBOC" />{{rp|6.2}}。RNAコード遺伝子の場合は、最初の段階を経なくてはならないが、タンパク質には翻訳されない<ref name="Edd01" />。RNAやタンパク質のように、生物学的に機能する分子を産生する過程は[[遺伝子発現]]と呼ばれ、その結果として生じる分子は[[遺伝子産物]]と呼ばれる。 |
|||
=== 遺伝暗号 === |
|||
[[File:RNA-codons-aminoacids.svg|thumb|upright=1.5|一連の3塩基[[コドン]]が見える一本鎖RNA分子の模式図。それぞれの3[[ヌクレオチド|塩基]]コドンは、タンパク質に翻訳されるときの1つの[[アミノ酸]]に対応する。|alt=An RNA molecule consisting of nucleotides. Groups of three nucleotides are indicated as codons, with each corresponding to a specific amino acid.]] |
|||
遺伝子のDNAのヌクレオチド配列は、[[遺伝情報|遺伝暗号]]を通じてタンパク質のアミノ酸配列を規定する。[[コドン]]と呼ばれる三連のヌクレオチドの集合は、それぞれが特定のアミノ酸に対応している<ref name="MBOC" />{{Rp|6}}。DNAの3つの連続した塩基が各アミノ酸をコードするという原理は、1961年にバクテリオファージT4のrIIB遺伝子のフレームシフト変異を使用して実証された<ref name="pmid13882203">{{cite journal | vauthors = Crick FH, Barnett L, Brenner S, Watts-Tobin RJ | title = General nature of the genetic code for proteins | journal = Nature | volume = 192 | issue = 4809 | pages = 1227–32 | date = December 1961 | pmid = 13882203 | doi = 10.1038/1921227a0 | s2cid = 4276146 | bibcode = 1961Natur.192.1227C }}</ref>({{Ill2|クリック-ブレナーらの実験|en|Crick, Brenner et al. experiment}}を参照)。 |
|||
さらに、1つの「[[開始コドン]]」と3種類の「[[終止コドン]]」が[[コーディング領域|タンパク質コード領域]]の開始と終了を示す。64種類のコドンが可能で(3つの位置に4種のヌクレオチドで4<sup>3</sup>通りの組合せが可能)、標準的なアミノ酸は20種類しかない。したがってコードは冗長であり、複数のコドンが同じアミノ酸を指定することができる。コドンとアミノ酸の対応は、既知のすべての生物においてほぼ共通である<ref>{{cite journal | vauthors = Crick FH | title = The genetic code | journal = Scientific American | volume = 207 | issue = 4 | pages = 66–74 | date = October 1962 | pmid = 13882204 | doi = 10.1038/scientificamerican1062-66 | url = http://profiles.nlm.nih.gov/ps/access/SCBBFY.ocr | publisher = WH Freeman and Company | bibcode = 1962SciAm.207d..66C }}</ref>。 |
|||
=== 転写 === |
|||
[[転写 (生物学)|転写]]により、[[メッセンジャーRNA]]と呼ばれる一本鎖[[リボ核酸|RNA]]分子が生成する。そのヌクレオチド配列は、転写元のDNAと相補的である<ref name="MBOC" />{{rp|6.1}}。mRNAは、DNA遺伝子とその最終産物であるタンパク質との中間体として機能する。遺伝子のDNAを鋳型として[[相補性 (分子生物学)|相補的]]なmRNAが生成される。mRNAは、[[鋳型鎖]]と相補的に合成されるため、遺伝子のDNA{{Ill2|コード鎖|en|Coding strand}}の配列と一致する。転写は[[RNAポリメラーゼ]]と呼ばれる[[酵素]]によって行われ、鋳型鎖を[[3'末端|3']]から[[5'末端|5']]の方向に読み取り、RNAを5'から3'の方向に合成する。転写を開始するために、ポリメラーゼがまず遺伝子の[[プロモーター]]領域を認識して結合する。したがって[[遺伝子発現の調節|遺伝子調節]]の主要な機構は、ポリメラーゼを物理的に遮断する[[リプレッサー]]分子による強固な結合か、プロモーター領域に接近できないようにDNAを組織化することにより、プロモーター領域を遮断または隔離することである<ref name="MBOC" />{{rp|7}}。 |
|||
[[原核生物]]では、転写は[[細胞質]]で行われる。非常に長い転写産物の場合、RNAの3'末端が転写されている間に、RNAの5'末端から翻訳が始まることがある。[[真核生物]]では、転写は細胞のDNAが保存されている[[細胞核|核]]で行われる。ポリメラーゼによって生成されたRNA分子は[[一次転写産物]]と呼ばれ、翻訳のために細胞質に輸送される前に[[転写後修飾]]を受ける。こうした修飾の一つに、転写領域にあるタンパク質をコードしない配列である[[イントロン]]の{{Ill2|RNAスプライシング|en|RNA splicing|label=スプライシング|preserve=1}}(除去)がある。[[選択的スプライシング]]機構により、同じ遺伝子から異なる配列を持つ(したがって異なるタンパク質をコードする)成熟転写産物が生成することもある。これは真核細胞における調節の主要な形態であり、一部の原核生物でも見られる<ref name="MBOC" />{{rp|7.5}}<ref>{{cite journal | vauthors = Woodson SA | title = Ironing out the kinks: splicing and translation in bacteria | journal = Genes & Development | volume = 12 | issue = 9 | pages = 1243–7 | date = May 1998 | pmid = 9573040 | doi = 10.1101/gad.12.9.1243 | doi-access = free }}</ref>。 |
|||
=== 翻訳 === |
|||
[[File:DNA to protein or ncRNA.svg|thumb|upright=1.5|タンパク質コード遺伝子は中間体の[[メッセンジャーRNA|mRNA]]に転写され、その後、機能的な[[タンパク質]]に翻訳される。RNAコード遺伝子は、機能的な[[非コードRNA]]に転写される。{{PDB|3BSE|1OBB|3TRA}}|alt=A protein-coding gene in DNA being transcribed and translated to a functional protein or a non-protein-coding gene being transcribed to a functional RNA]] |
|||
[[翻訳 (生物学)|翻訳]]は、[[成熟mRNA]]を鋳型として、新しい[[タンパク質]]を合成する過程である<ref name="MBOC" />{{rp|6.2}}。翻訳は、RNAとタンパク質からなる大きな複合体である[[リボソーム]]によって行われ、これは[[ペプチド結合]]を形成することで、伸長する[[ポリペプチド]]鎖に新しい[[アミノ酸]]を付加する化学反応を行う役割を担っている。遺伝暗号は、[[トランスファーRNA]](tRNA)と呼ばれる特殊なRNA分子との相互作用を通じて、[[コドン]]と呼ばれる単位で一度に3塩基ずつ読み取られる。それぞれのtRNAは、mRNA上で読み取られるコドンと相補的な[[アンチコドン]]という3つの不対塩基を持っている。また、tRNAは相補的コドンによって指定されるアミノ酸とも[[共有結合]]している。tRNAがmRNA鎖の相補的コドンに結合すると、リボソームはそのアミノ酸を新しいポリペプチド鎖に結合させ、ポリペプチド鎖が[[アミノ末端]]から[[カルボキシル末端]]まで合成される。合成中および合成後も、ほとんどの新しいタンパク質はその細胞機能を発揮する前に、活性を持った[[三次構造|三次元構造]]に[[タンパク質フォールディング|折り畳まれ]]なければならない<ref name="MBOC" />{{rp|3}}。 |
|||
=== 調節 === |
|||
[[遺伝子発現|遺伝子の発現]]は限られた資源を利用するので、その産物が必要な時だけ発現が行われるように[[遺伝子発現の調節|調節]]されている<ref name="MBOC" />{{rp|7}}。細胞は、その[[自然環境|外部環境]](利用可能な[[栄養素]]、[[熱ショックタンパク質|温度]]、その他の{{Ill2|細胞ストレス応答|en|Cellular stress response|label=ストレス}})、その内部環境([[細胞周期|細胞分裂周期]]、[[代謝]]、[[感染|感染状態]]など)、および[[多細胞生物|多細胞]]生物であればその[[細胞分化|特定の役割]]に応じて遺伝子発現を調節する。遺伝子発現は、{{Ill2|転写制御|en|Transcriptional regulation|label=転写の開始}}から[[転写後修飾|RNAプロセシング]]、タンパク質の[[翻訳後修飾]]に至るまで、あらゆる段階で制御することができる。[[大腸菌]]における[[乳糖不耐症|乳糖]]代謝遺伝子の調節([[ラクトースオペロン|''lac''オペロン]])は、1961年に初めて報告されたそうした機構である<ref>{{cite journal | vauthors = Jacob F, Monod J | title = Genetic regulatory mechanisms in the synthesis of proteins | journal = Journal of Molecular Biology | volume = 3 | issue = 3 | pages = 318–56 | date = June 1961 | pmid = 13718526 | doi = 10.1016/S0022-2836(61)80072-7 | s2cid = 19804795 | author-link = François Jacob | author-link2 = Jacques Monod }} |
|||
</ref>。 |
|||
=== RNA遺伝子 === |
|||
典型的なタンパク質コード遺伝子は、最終タンパク質産物の生成過程における中間体として、まず[[リボ核酸|RNA]]に転写される<ref name="MBOC" />{{rp|6.1}}。また、[[リボソームRNA]]や[[トランスファーRNA]]の合成のように、RNA分子が実際の機能産物となる場合もある。[[リボザイム]]として知られるRNAの中には[[酵素|酵素機能]]を持つものもあれば、[[マイクロRNA]]や[[リボスイッチ]]のように制御的な役割を持つものもある。このようなRNAが転写される[[デオキシリボ核酸|DNA]]配列は、[[ノンコーディングRNA|非コードRNA遺伝子]]として知られている<ref name="Edd01">{{cite journal | vauthors = Eddy SR | title = Non-coding RNA genes and the modern RNA world | journal = Nature Reviews. Genetics | volume = 2 | issue = 12 | pages = 919–29 | date = December 2001 | pmid = 11733745 | doi = 10.1038/35103511 | s2cid = 18347629 }}</ref>。 |
|||
[[ウイルス]]の中には、ゲノム全体を[[リボ核酸|RNA]]の形で保存し、DNAをまったく含まないものもある<ref>{{cite journal | vauthors = Koonin EV, Dolja VV | title = Evolution and taxonomy of positive-strand RNA viruses: implications of comparative analysis of amino acid sequences | journal = Critical Reviews in Biochemistry and Molecular Biology | volume = 28 | issue = 5 | pages = 375–430 | date = January 1993 | pmid = 8269709 | doi = 10.3109/10409239309078440 }}</ref><ref>{{cite journal| vauthors = Domingo E |title=RNA Virus Genomes|journal=eLS|date=2001|doi=10.1002/9780470015902.a0001488.pub2|isbn=978-0470016176}}</ref>。遺伝子の保存にRNAを使用するため、[[宿主]][[細胞]]は[[感染]]するとすぐに、転写を待つことなくタンパク質を合成することができる<ref>{{cite journal | vauthors = Domingo E, Escarmís C, Sevilla N, Moya A, Elena SF, Quer J, Novella IS, Holland JJ | display-authors = 6 | title = Basic concepts in RNA virus evolution | journal = FASEB Journal | volume = 10 | issue = 8 | pages = 859–64 | date = June 1996 | pmid = 8666162 | doi = 10.1096/fasebj.10.8.8666162 | s2cid = 20865732 }}</ref>。対照的に、[[ヒト免疫不全ウイルス|HIV]]のようなRNA[[レトロウイルス科|レトロウイルス]]は、タンパク質が合成される前に、[[ゲノム]]をRNAからDNAに[[逆転写酵素|逆転写]]する必要がある。 |
|||
==遺伝== |
|||
[[File: Autosomal recessive - mini.svg|thumb|2つの異なる[[アレル]] (青と白) を持つ遺伝子の継承を示す模式図。この遺伝子は[[常染色体]]上に存在する。白いアレルは青いアレルに対して[[潜性]]である。子供たちの世代における各結果の確率は4分の1、つまり25%である。|alt=Illustration of autosomal recessive inheritance. Each parent has one blue allele and one white allele. Each of their 4 children inherit one allele from each parent such that one child ends up with two blue alleles, one child has two white alleles and two children have one of each allele. Only the child with both blue alleles shows the trait because the trait is recessive.]]{{main|メンデルの法則<!-- Mendelian inheritance -->|遺伝<!-- Heredity -->}} |
|||
生物は両親から遺伝子を受け継ぐ。[[無性生殖|無性生物]]は、親のゲノムの完全な写しを継承するだけである。[[有性生殖|有性生物]]は、それぞれの親から完全な染色体を1セットずつ継承するので、各染色体の写しを2つ持っている<ref name="MBOC" />{{rp|1}}。 |
|||
=== メンデル遺伝 === |
|||
[[メンデル遺伝]]によれば、生物の[[表現型]](観察可能な身体的/行動的特徴)の変異は、[[遺伝型]](特定の遺伝子の集合)の変異に部分的に起因している。各遺伝子は特定の表現型形質を規定し、遺伝子の異なる配列([[アレル]])が異なる表現型を引き起こす。ほとんどの真核生物(メンデルが研究したエンドウ豆の植物など)は、それぞれの形質ごとに2つのアレルを持ち、それぞれの親から1つずつ受け継がれる<ref name="MBOC" />{{rp|20}}。 |
|||
[[遺伝子座|座位]](遺伝子座とも)におけるアレルには[[顕性]]アレルと[[潜性]]アレルがあり、顕性アレルは同じ形質について他のどのアレルとも対になっても対応する表現型を生じるが、潜性アレルは同じアレルと対になったときにのみ表現型を生じる。もし生物の遺伝型がわかっていれば、どのアレルが顕性で、どのアレルが潜性かを決定することができる。たとえば、エンドウの高い背丈を規定するアレルが、低い背丈を規定するアレルより顕性であれば、一方の親から背丈の高いアレルを、他方の親から背丈の低いアレルを受け継いだエンドウも高い背丈を持つことになる。メンデルの研究は、[[配偶子]]([[生殖細胞]])の生成においてアレルが独立に組み入れられて、次世代における変異が保証されることを示した。メンデル遺伝は、単一遺伝子によって決定される多くの形質(よく知られた[[遺伝性疾患]]の多くを含む)に対して、依然として優れたモデルであるが、DNA複製と細胞分裂の物理的過程は含まれていない<ref name="scitable_miko">{{cite journal | vauthors = Miko I | title = Gregor Mendel and the Principles of Inheritance | url = http://www.nature.com/scitable/topicpage/gregor-mendel-and-the-principles-of-inheritance-593 | journal = Nature Education Knowledge | date = 2008 | volume = 1 | issue = 1 | page = 134 | series = SciTable | publisher = Nature Publishing Group }}</ref><ref name="scitable_chial">{{cite journal | vauthors = Chial H | title = Mendelian Genetics: Patterns of Inheritance and Single-Gene Disorders | url = http://www.nature.com/scitable/topicpage/mendelian-genetics-patterns-of-inheritance-and-single-966 | journal = Nature Education Knowledge | date = 2008 | volume = 1 | issue = 1 | page = 63 | series = SciTable | publisher = Nature Publishing Group }}</ref>。 |
|||
=== DNA複製と細胞分裂 === |
|||
生物の成長、発達、繁殖は[[細胞分裂]]に依存している。細胞分裂とは、一つの[[細胞]]が(通常は同等の)二つの[[娘細胞]]に分裂する過程である。そのためにはまず、[[DNA複製]]と呼ばれる過程で、[[ゲノム]]中のすべての遺伝子の写しを作る必要がある<ref name="MBOC" />{{rp|5.2}}。複製は[[DNAポリメラーゼ]]と呼ばれる特殊な[[酵素]]によって行われ、二重らせんDNAの一方の鎖(鋳型鎖という)を「読み取り」、新しい相補鎖を合成する。DNAの二重らせんは[[塩基対]]を形成して相互に結合されているため、一方の鎖の塩基配列はその相補鎖の塩基配列を明確に規定する。したがって、正確な写しを作るためには、一方の鎖だけを酵素が読み取ればよい。DNA複製の過程は[[半保存的複製|半保存的]]であり、各娘細胞に受け継がれるゲノムの2本のDNA鎖には、元のDNA鎖と新しく合成されたDNA鎖が1つずつ含まれている<ref name="MBOC" />{{rp|5.2}}。 |
|||
生きた細胞におけるDNA複製の速度は、ファージに感染した大腸菌におけるファージT4 DNAの伸長速度で初めて測定され、驚くほど速いことがわかった<ref name="pmid789903">{{cite journal | vauthors = McCarthy D, Minner C, Bernstein H, Bernstein C | title = DNA elongation rates and growing point distributions of wild-type phage T4 and a DNA-delay amber mutant | journal = Journal of Molecular Biology | volume = 106 | issue = 4 | pages = 963–81 | date = October 1976 | pmid = 789903 | doi = 10.1016/0022-2836(76)90346-6 }}</ref>。37 °Cでの指数関数的なDNA増加期間において、伸長速度は749ヌクレオチド/秒であった。 |
|||
DNA複製が完了すると、細胞はゲノムの2つの写しを物理的に分離し、2つの異なる膜結合した細胞に分裂しなければならない<ref name="MBOC" />{{rp|18.2}}。[[原核生物]]([[細菌]]と[[古細菌]])では、これは通常、[[二分裂]]と呼ばれる比較的単純な過程で行われる。二分裂では、それぞれの環状ゲノムが[[細胞膜]]に付着し、細胞膜が{{Ill2|陥入|en|Invagination}}して[[細胞質]]を2つの膜結合部分に分割するときに娘細胞に分離される。二分裂は、[[真核生物]]の細胞分裂の速度と比べると極めて速い。真核生物の細胞分裂は、[[細胞周期]]として知られるより複雑な過程を経て行われる。DNAの複製は、細胞周期の[[S期]]という段階で起こり、染色体の分離と細胞質の分裂は[[M期]]で起こる<ref name="MBOC" />{{rp|18.1}}。 |
|||
=== 分子遺伝 === |
|||
ある世代の細胞から次の世代の細胞への遺伝物質の複製と伝達は、分子遺伝の基礎であり、遺伝子の古典的な像と分子的な像との接点でもある。生物が両親の特徴を受け継ぐのは、子孫の細胞には両親のそれぞれの細胞に由来する遺伝子の写しが含まれているからである。[[無性生殖]]をする生物では、子孫は親の遺伝的複製あるいは{{Ill2|分子クローニング|en|Molecular cloning|label=クローン}}となる。[[有性生殖]]をする生物では、[[減数分裂]]と呼ばれる特殊な細胞分裂によって、[[配偶子]]または[[生殖細胞]]と呼ばれる[[単数体]]、すなわち各遺伝子の写しを1つだけ含む細胞が作られる<ref name="MBOC" />{{rp|20.2}}。雌性(しせい)配偶子は[[卵]]または[[卵子]]と呼ばれ、雄性(ゆうせい)配偶子は精細胞または[[精子]]と呼ばれる。2つの配偶子が融合して[[二倍体]]の[[受精卵]]が形成される。受精卵は、2組の遺伝子を持つ単一の細胞であり、それぞれの遺伝子の写しは母親から1つ、父親から1つである<ref name="MBOC" />{{rp|20}}。 |
|||
減数分裂の細胞分裂の過程で、[[遺伝的組換え]]、あるいは[[乗換え (生物学)|乗換え]]と呼ばれる現象が起こることがある。この現象では、一方の[[染色分体]]上のDNA断片<!-- length of DNA -->が、対応する相同な非姉妹染色分体上のDNA断片と入れ替わる。この結果、アレルが{{Ill2|再集合 (遺伝学)|en|Reassortment|label=再集合}}する可能性がある<ref name="MBOC" />{{rp|5.5}}。メンデルの{{Ill2|メンデルの独立組合せの法則|en|Mendel’s law of independent assortment|label=独立組合せの法則}}は、両親の各形質に関する2つの遺伝子が、それぞれ独立して配偶子に組み入れられるというもので、ある形質について生物がどのアレルを受け継ぐかは、別の形質についてどのアレルを受け継ぐかとは無関係である。実際には、このことは、同じ染色体上に存在しない遺伝子、あるいは同じ染色体上で互いに非常に離れた位置にある遺伝子にのみ当てはまる。2つの遺伝子が同じ染色体上で近くに存在するほど、配偶子においてより密接に関連し、一緒に現れる頻度も高くなる([[遺伝的連鎖]]と呼ばれる)<ref name="scitable_lobo">{{cite journal| vauthors = Lobo I, Shaw K |date=2008|title=Discovery and Types of Genetic Linkage|url=http://www.nature.com/scitable/topicpage/discovery-and-types-of-genetic-linkage-500|journal=Nature Education Knowledge|series=SciTable|publisher=Nature Publishing Group|volume=1|issue=1|page=139}}</ref>。互いに非常に近い遺伝子は、その間に交叉(こうさ)点が生じる可能性が極めて低いため、基本的に分離することはない<ref name="scitable_lobo" />。 |
|||
== 分子進化 == |
|||
{{Main|分子進化<!-- Molecular evolution -->}} |
|||
=== 変異 === |
|||
DNAの複製は、ほとんどの場合非常に正確であるが、[[変異]](突然変異とも)と呼ばれるエラーが起こることもある<ref name="MBOC" />{{rp|7.6}}。[[真核生物|真核]][[細胞]]におけるエラー率は、1回の複製につき[[ヌクレオチド]]あたり10<sup>−8</sup>と低いこともあるが<ref name="Nachman">{{cite journal | vauthors = Nachman MW, Crowell SL | title = Estimate of the mutation rate per nucleotide in humans | journal = Genetics | volume = 156 | issue = 1 | pages = 297–304 | date = September 2000 | doi = 10.1093/genetics/156.1.297 | pmid = 10978293 | pmc = 1461236 | url = http://www.genetics.org/cgi/content/full/156/1/297 }}</ref><ref name="Science2">{{cite journal | vauthors = Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT, Rowen L, Pant KP, Goodman N, Bamshad M, Shendure J, Drmanac R, Jorde LB, Hood L, Galas DJ | display-authors = 6 | title = Analysis of genetic inheritance in a family quartet by whole-genome sequencing | journal = Science | volume = 328 | issue = 5978 | pages = 636–9 | date = April 2010 | pmid = 20220176 | pmc = 3037280 | doi = 10.1126/science.1186802 | bibcode = 2010Sci...328..636R }}</ref>、一部のRNAウイルスでは10<sup>−3</sup>と高いことがある<ref name="Genetics2">{{cite journal | vauthors = Drake JW, Charlesworth B, Charlesworth D, Crow JF | title = Rates of spontaneous mutation | journal = Genetics | volume = 148 | issue = 4 | pages = 1667–86 | date = April 1998 | doi = 10.1093/genetics/148.4.1667 | pmid = 9560386 | pmc = 1460098 | url = http://www.genetics.org/cgi/content/full/148/4/1667 }}</ref>。このことは、ヒトゲノムの場合、世代ごとに約30個の新しい変異が蓄積されることを意味する<ref>Pyeritz, Reed E., Bruce R. Korf, and Wayne W. Grody, eds. Emery and Rimoin’s principles and practice of medical genetics and genomics: foundations. Academic Press, 2018.</ref>。小さな変異は、[[DNA複製]]や[[DNA損傷]]の結果として引き起こされる場合があり、単一の塩基が変更される[[点変異]]や、単一の塩基が挿入または欠失する[[フレームシフト変異]]が含まれる。これらの変異はいずれも、[[ミスセンス突然変異|ミスセンス]](コドンを変更して別のアミノ酸をコードする)または[[ナンセンス突然変異|ナンセンス]](途中で[[終止コドン]]が生じる)によって遺伝子を変化させる場合がある<ref>{{cite web|title=What kinds of gene mutations are possible?|url=http://ghr.nlm.nih.gov/handbook/mutationsanddisorders/possiblemutations|website=Genetics Home Reference|publisher=United States National Library of Medicine|access-date=19 May 2015|date=11 May 2015}}</ref>。より大きな変異は、組換えエラーによって引き起こされる可能性があり、染色体の大きな部分の[[遺伝子重複|重複]]、欠失、再配列または逆位などの[[染色体異常]]が生じる。さらに、DNA修復機構が分子の物理的損傷を修復する際に変異エラーを引き起こすこともある。生存という観点においては、変異があっても修復する方が(たとえば[[二重鎖切断|二本鎖切断]]の修復)、正確な写しを復元するよりも重要である<ref name="MBOC" />{{rp|5.4}}。 |
|||
ある種の集団において、複数の異なる遺伝子の[[アレル]]が存在する場合、その遺伝子は[[多型]]と呼ばれる。ほとんどの異なるアレルは機能的に同等であるが、アレルの中には異なる[[形質|表現型形質]]を引き起こすこともある。遺伝子の最も一般的なアレルは[[野生型]]と呼ばれ、稀なアレルは[[変形|変異体]]と呼ばれる。集団内における異なるアレル頻度の[[遺伝的変異]]は、[[自然選択説|自然選択]]と[[遺伝的浮動]]の両方によるものである<ref>{{cite journal| vauthors = Andrews CA |title=Natural Selection, Genetic Drift, and Gene Flow Do Not Act in Isolation in Natural Populations|journal=Nature Education Knowledge|date=2010|volume=3|issue=10|page=5|url=http://www.nature.com/scitable/knowledge/library/natural-selection-genetic-drift-and-gene-flow-15186648|series=SciTable|publisher=Nature Publishing Group}}</ref>。野生型アレルは、必ずしも稀なアレルの[[祖先]]であるとは限らないし、より[[適応度|適応]]しているとも限らない。 |
|||
遺伝子内の変異のほとんどは{{Ill2|中立変異|en|Neutral mutation|label=中立}}で、生物の表現型に影響を与えない([[サイレント変異]])。複数のコドンが同じアミノ酸をコードするため、アミノ酸配列が変化しない変異もある({{Ill2|同義置換|en|Synonymous substitution}})。その他の変異には中立的なものもあり、たとえば{{Ill2|保存的置換|en|Conservative replacement}}は、アミノ酸配列が変化しても、タンパク質が新しいアミノ酸でも同様に機能する。しかし、多くの変異は[[変異|有害]]または[[モモ (児童文学)|致死的]]であり、自然選択によって集団から取り除かれる。遺伝性疾患は有害突然変異<!-- deleterious mutations -->の結果であり、罹患者(りかんじゃ)の自然変異が原因で起こることもあれば、遺伝することもある。最後に、ごく一部の変異は生物の[[適応度|適応]]を向上させる{{Ill2|有益な変異|en|Beneficial mutation|label=有益}}なものであり、その{{Ill2|定方向選択|en|Directional selection}}が適応[[進化]]をもたらすため、進化にとって極めて重要である<ref name="MBOC" />{{rp|7.6}}。 |
|||
=== 配列相同性 === |
|||
遺伝子間の関係は、DNAの[[シーケンスアラインメント|配列]]を比較することによって測定することができる。類似性の程度が最低線を上回れば、その遺伝子は共通の祖先の子孫であると結論づけることができる。それらは{{Ill2|配列相同性|en|Sequence homology|label=相同}}であるという<ref>{{cite journal | vauthors = Patterson C | title = Homology in classical and molecular biology | journal = Molecular Biology and Evolution | volume = 5 | issue = 6 | pages = 603–25 | date = November 1988 | pmid = 3065587 | doi = 10.1093/oxfordjournals.molbev.a040523 | doi-access = free }}</ref><ref>{{cite book | vauthors = Graur D | date = 2016 | title = Molecular and Genome Evolution | publisher = Sinauer Associates, Inc. | place = Sunderland MA (US) | isbn = 9781605354699}}</ref>。共通の祖先からの直接の子孫によって関連している遺伝子はオルソロガス遺伝子<!-- orthologous genes -->であり、それらは通常、異なる種の同じ座位に見いだされる。遺伝子重複の結果として関連する遺伝子はパラロガス遺伝子<!-- parologous genes -->と呼ばれる<ref>{{cite book | vauthors = Graur D | date = 2016 | title = Molecular and Genome Evolution | publisher = Sinauer Associates, Inc. | place = Sunderland MA (US) | isbn = 9781605354699}}</ref><ref>{{cite journal | vauthors = Jensen RA | title = Orthologs and paralogs - we need to get it right | journal = Genome Biology | volume = 2 | issue = 8 | pages = INTERACTIONS1002 | date = 2001 | pmid = 11532207 | doi = 10.1186/gb-2001-2-8-interactions1002 | pmc = 138949 | doi-access = free }}</ref>。 |
|||
オルソロガス遺伝子の機能は、パラロガス遺伝子よりも類似しているとしばしば考えられるが、その違いはわずかである<ref>{{cite journal | vauthors = Studer RA, Robinson-Rechavi M | title = How confident can we be that orthologs are similar, but paralogs differ? | journal = Trends in Genetics | volume = 25 | issue = 5 | pages = 210–6 | date = May 2009 | pmid = 19368988 | doi = 10.1016/j.tig.2009.03.004 | url = https://serval.unil.ch/notice/serval:BIB_39F8106EE698 }}</ref><ref>{{cite journal | vauthors = Altenhoff AM, Studer RA, Robinson-Rechavi M, Dessimoz C | title = Resolving the ortholog conjecture: orthologs tend to be weakly, but significantly, more similar in function than paralogs | journal = PLOS Computational Biology | volume = 8 | issue = 5 | pages = e1002514 | date = 2012 | pmid = 22615551 | pmc = 3355068 | doi = 10.1371/journal.pcbi.1002514 | bibcode = 2012PLSCB...8E2514A | doi-access = free }} {{open access}}</ref>。 |
|||
=== 新しい遺伝子の起源 === |
|||
[[File:Evolution fate duplicate genes - vector.svg|thumb|upright=1.35|重複遺伝子の3つの進化的運命]] |
|||
真核生物の系統において、新しい遺伝子が生まれる最も一般的な原因は、ゲノム上に存在する遺伝子の[[コピー数多型|コピー数に変異]]が起こる[[遺伝子重複]]である<ref name="guerzoni">{{cite journal | vauthors = Guerzoni D, McLysaght A | title = De novo origins of human genes | journal = PLOS Genetics | volume = 7 | issue = 11 | pages = e1002381 | date = November 2011 | pmid = 22102832 | pmc = 3213182 | doi = 10.1371/journal.pgen.1002381 | doi-access = free }} {{open access}}</ref><ref>{{cite journal | vauthors = Reams AB, Roth JR | title = Mechanisms of gene duplication and amplification | journal = Cold Spring Harbor Perspectives in Biology | volume = 7 | issue = 2 | pages = a016592 | date = February 2015 | pmid = 25646380 | pmc = 4315931 | doi = 10.1101/cshperspect.a016592 }}</ref>。この結果として生じる遺伝子({{Ill2|配列相同性|en|Sequence homology#Paralogy|label=パラログ}})は、配列や機能が分岐する可能性がある。このようにして形成された遺伝子の集合が[[遺伝子ファミリー]]を構成する。ファミリー内での遺伝子の重複や消失は一般的で、進化における[[生物多様性]]の重要な要因となっている<ref>{{cite journal | vauthors = Demuth JP, De Bie T, Stajich JE, Cristianini N, Hahn MW | title = The evolution of mammalian gene families | journal = PLOS ONE| volume = 1 | issue = 1 | pages = e85 | date = December 2006 | pmid = 17183716 | pmc = 1762380 | doi = 10.1371/journal.pone.0000085 | bibcode = 2006PLoSO...1...85D | doi-access = free }} {{open access}}</ref>。遺伝子重複の結果、ある遺伝子の複製が機能しなくなることや、機能する複製が変異を受けて機能を失うこともある。このような機能しない遺伝子は[[偽遺伝子]]と呼ばれる<ref name="MBOC" />{{rp|7.6}}。 |
|||
{{Ill2|オーファン遺伝子|en|Orphan gene}}は、その配列が既存の遺伝子と類似性を示さないもので、遺伝子重複よりも稀である。ヒトゲノムには、ヒト以外の生物で同定可能な{{Ill2|配列相同性|en|Sequence homology|label=相同遺伝子}}を持たない遺伝子が18個-60個含まれていると推定されている<ref>{{cite journal | vauthors = Knowles DG, McLysaght A | title = Recent de novo origin of human protein-coding genes | journal = Genome Research | volume = 19 | issue = 10 | pages = 1752–9 | date = October 2009 | pmid = 19726446 | pmc = 2765279 | doi = 10.1101/gr.095026.109 }}</ref><ref>{{cite journal | vauthors = Wu DD, Irwin DM, Zhang YP | title = De novo origin of human protein-coding genes | journal = PLOS Genetics | volume = 7 | issue = 11 | pages = e1002379 | date = November 2011 | pmid = 22102831 | pmc = 3213175 | doi = 10.1371/journal.pgen.1002379 | doi-access = free }} {{open access}}</ref>。オーファン遺伝子は主に、以前は[[非コードDNA|非コード配列]]であったものから出現した{{Ill2|de novo遺伝子誕生|en|De novo gene birth|label=''de novo''遺伝子}}か、あるいは遺伝子重複の後に急速に配列が変化して元の関係が検出できなくなったもののいずれかとして生じる<ref>{{cite journal | vauthors = McLysaght A, Guerzoni D | title = New genes from non-coding sequence: the role of de novo protein-coding genes in eukaryotic evolutionary innovation | journal = Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences | volume = 370 | issue = 1678 | pages = 20140332 | date = September 2015 | pmid = 26323763 | pmc = 4571571 | doi = 10.1098/rstb.2014.0332 }}</ref>。''de novo''遺伝子は一般的に、ほとんどの真核生物遺伝子よりも短く単純な構造をしており、イントロンはあったとしてもほとんどない<ref name="guerzoni" />。長い進化の過程においては、''de novo''遺伝子の誕生が、分類学的に制限された遺伝子ファミリーのかなりの部分に関与している可能性がある<ref>{{cite journal | vauthors = Neme R, Tautz D | title = Phylogenetic patterns of emergence of new genes support a model of frequent de novo evolution | journal = BMC Genomics | volume = 14 | issue = 1 | pages = 117 | date = February 2013 | pmid = 23433480 | pmc = 3616865 | doi = 10.1186/1471-2164-14-117 | doi-access = free }}</ref>。 |
|||
[[遺伝子の水平伝播]]とは、[[生殖]]以外の機構による遺伝物質の伝達を指す。この機構は、[[原核生物]]において新しい遺伝子が生まれる一般的な原因であり、遺伝子重複よりも遺伝的変異により多く寄与していると考えられることもある<ref>{{cite journal | vauthors = Treangen TJ, Rocha EP | title = Horizontal transfer, not duplication, drives the expansion of protein families in prokaryotes | journal = PLOS Genetics | volume = 7 | issue = 1 | pages = e1001284 | date = January 2011 | pmid = 21298028 | pmc = 3029252 | doi = 10.1371/journal.pgen.1001284 | doi-access = free }} {{open access}}</ref>。これは、[[抗生物質耐性]]、[[病原性]]、適応的[[代謝]]機能を広めるための一般的な手段である<ref name="bennett" /><ref>{{cite journal | vauthors = Ochman H, Lawrence JG, Groisman EA | title = Lateral gene transfer and the nature of bacterial innovation | journal = Nature | volume = 405 | issue = 6784 | pages = 299–304 | date = May 2000 | pmid = 10830951 | doi = 10.1038/35012500 | s2cid = 85739173 | bibcode = 2000Natur.405..299O }}</ref>。遺伝子の水平伝播は真核生物では稀であるが、[[原生生物]]や[[藻類]]のゲノムでは、細菌の遺伝子が含まれている可能性が高い例が同定されている<ref>{{cite journal | vauthors = Keeling PJ, Palmer JD | title = Horizontal gene transfer in eukaryotic evolution | journal = Nature Reviews. Genetics | volume = 9 | issue = 8 | pages = 605–18 | date = August 2008 | pmid = 18591983 | doi = 10.1038/nrg2386 | s2cid = 213613 }}</ref><ref>{{cite journal | vauthors = Schönknecht G, Chen WH, Ternes CM, Barbier GG, Shrestha RP, Stanke M, Bräutigam A, Baker BJ, Banfield JF, Garavito RM, Carr K, Wilkerson C, Rensing SA, Gagneul D, Dickenson NE, Oesterhelt C, Lercher MJ, Weber AP | display-authors = 6 | title = Gene transfer from bacteria and archaea facilitated evolution of an extremophilic eukaryote | journal = Science | volume = 339 | issue = 6124 | pages = 1207–10 | date = March 2013 | pmid = 23471408 | doi = 10.1126/science.1231707 | url = https://pub.uni-bielefeld.de/record/2915146 | s2cid = 5502148 | bibcode = 2013Sci...339.1207S }}</ref>。 |
|||
== ゲノム == |
|||
[[ゲノム]]は生物の遺伝物質の全体であり、遺伝子と[[非コード配列]]の両方を含む<ref>Ridley, M. (2006). ''Genome''. New York, NY: Harper Perennial. {{ISBN|0-06-019497-9}}</ref>。真核生物の遺伝子の構造や機能を分析するために、[[機能ゲノミクス#ゲノムアノテーション|アノテーション]](注釈)をするFINDERなどのツールが使用される<ref name="pmid33879057">{{cite journal | vauthors = Banerjee S, Bhandary P, Woodhouse M, Sen TZ, Wise RP, Andorf CM | title = FINDER: an automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences | journal = BMC Bioinformatics | volume = 44 | issue = 9 | pages = e89 | date = Apr 2021 | pmid = 33879057 | doi = 10.1186/s12859-021-04120-9 | pmc = 8056616 | doi-access = free }}</ref>。 |
|||
=== 遺伝子数 === |
|||
[[File:Gene numbers.svg|thumb|upright=2.55|代表的な[[植物]] (緑色)、[[脊椎動物]] (青色)、[[無脊椎動物]] (オレンジ色)、[[真菌類|真菌]] (黄色)、[[細菌]] (紫色)、および[[ウイルス]] (灰色) の遺伝子数を面積で比較した。右の挿入図は小さなゲノムを100倍に拡大した。<ref name="WatsonJD">Watson, JD, Baker TA, Bell SP, Gann A, Levine M, Losick R. (2004). "Ch9-10", Molecular Biology of the Gene, 5th ed., Peason Benjamin Cummings; CSHL Press.</ref><ref>{{cite web |url=http://www.ebi.ac.uk/integr8/OrganismStatsAction.do;jsessionid=08E9058B5B688A4F7FF7D161CB9E36A4?orgProteomeId=3 |title=Integr8 – A.thaliana Genome Statistics |access-date=2015-04-26}}</ref><ref>{{cite web|title=Understanding the Basics|url=http://web.ornl.gov/sci/techresources/Human_Genome/project/info.shtml|website=The Human Genome Project|access-date=26 April 2015}}</ref><ref>{{cite web |date=10 August 2011 |title=WS227 Release Letter |publisher=WormBase |url=http://www.wormbase.org/wiki/index.php/WS227 |archive-url=https://archive.today/20131128221823/http://www.wormbase.org/wiki/index.php/WS227 |url-status=dead |archive-date=28 November 2013 |access-date=19 November 2013}}</ref><ref name="pmid11935017" /><ref name="mitochondrial_genome">{{cite journal | vauthors = Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG | display-authors = 6 | title = Sequence and organization of the human mitochondrial genome | journal = Nature | volume = 290 | issue = 5806 | pages = 457–65 | date = April 1981 | pmid = 7219534 | doi = 10.1038/290457a0 | s2cid = 4355527 | bibcode = 1981Natur.290..457A }}</ref><ref>{{cite journal | vauthors = Adams MD, Celniker SE, Holt RA, Evans CA, Gocayne JD, Amanatides PG, Scherer SE, Li PW, Hoskins RA, Galle RF, George RA, Lewis SE, Richards S, Ashburner M, Henderson SN, Sutton GG, Wortman JR, Yandell MD, Zhang Q, Chen LX, Brandon RC, Rogers YH, Blazej RG, Champe M, Pfeiffer BD, Wan KH, Doyle C, Baxter EG, Helt G, Nelson CR, Gabor GL, Abril JF, Agbayani A, An HJ, Andrews-Pfannkoch C, Baldwin D, Ballew RM, Basu A, Baxendale J, Bayraktaroglu L, Beasley EM, Beeson KY, Benos PV, Berman BP, Bhandari D, Bolshakov S, Borkova D, Botchan MR, Bouck J, Brokstein P, Brottier P, Burtis KC, Busam DA, Butler H, Cadieu E, Center A, Chandra I, Cherry JM, Cawley S, Dahlke C, Davenport LB, Davies P, de Pablos B, Delcher A, Deng Z, Mays AD, Dew I, Dietz SM, Dodson K, Doup LE, Downes M, Dugan-Rocha S, Dunkov BC, Dunn P, Durbin KJ, Evangelista CC, Ferraz C, Ferriera S, Fleischmann W, Fosler C, Gabrielian AE, Garg NS, Gelbart WM, Glasser K, Glodek A, Gong F, Gorrell JH, Gu Z, Guan P, Harris M, Harris NL, Harvey D, Heiman TJ, Hernandez JR, Houck J, Hostin D, Houston KA, Howland TJ, Wei MH, Ibegwam C, Jalali M, Kalush F, Karpen GH, Ke Z, Kennison JA, Ketchum KA, Kimmel BE, Kodira CD, Kraft C, Kravitz S, Kulp D, Lai Z, Lasko P, Lei Y, Levitsky AA, Li J, Li Z, Liang Y, Lin X, Liu X, Mattei B, McIntosh TC, McLeod MP, McPherson D, Merkulov G, Milshina NV, Mobarry C, Morris J, Moshrefi A, Mount SM, Moy M, Murphy B, Murphy L, Muzny DM, Nelson DL, Nelson DR, Nelson KA, Nixon K, Nusskern DR, Pacleb JM, Palazzolo M, Pittman GS, Pan S, Pollard J, Puri V, Reese MG, Reinert K, Remington K, Saunders RD, Scheeler F, Shen H, Shue BC, Sidén-Kiamos I, Simpson M, Skupski MP, Smith T, Spier E, Spradling AC, Stapleton M, Strong R, Sun E, Svirskas R, Tector C, Turner R, Venter E, Wang AH, Wang X, Wang ZY, Wassarman DA, Weinstock GM, Weissenbach J, Williams SM, Worley KC, Wu D, Yang S, Yao QA, Ye J, Yeh RF, Zaveri JS, Zhan M, Zhang G, Zhao Q, Zheng L, Zheng XH, Zhong FN, Zhong W, Zhou X, Zhu S, Zhu X, Smith HO, Gibbs RA, Myers EW, Rubin GM, Venter JC | display-authors = 6 | title = The genome sequence of Drosophila melanogaster | journal = Science | volume = 287 | issue = 5461 | pages = 2185–95 | date = March 2000 | pmid = 10731132 | doi = 10.1126/science.287.5461.2185 | citeseerx = 10.1.1.549.8639 | bibcode = 2000Sci...287.2185. }}</ref><ref name="ReferenceB">{{cite journal | vauthors = Pertea M, Salzberg SL | title = Between a chicken and a grape: estimating the number of human genes | journal = Genome Biology | volume = 11 | issue = 5 | pages = 206 | date = 2010 | pmid = 20441615 | pmc = 2898077 | doi = 10.1186/gb-2010-11-5-206 | doi-access = free }}</ref>]] |
|||
{{Ill2|ゲノムの大きさ|en|Genome size|label=}}と、それがコードする遺伝子の数は、生物によって大きく異なる。最も小さなゲノムは[[ウイルス]]<ref>{{cite journal | vauthors = Belyi VA, Levine AJ, Skalka AM | title = Sequences from ancestral single-stranded DNA viruses in vertebrate genomes: the parvoviridae and circoviridae are more than 40 to 50 million years old | journal = Journal of Virology | volume = 84 | issue = 23 | pages = 12458–62 | date = December 2010 | pmid = 20861255 | pmc = 2976387 | doi = 10.1128/JVI.01789-10 }}</ref>や[[ウイロイド]]<ref>{{cite journal |vauthors=Flores R, Di Serio F, Hernández C |title=Viroids: The Noncoding Genomes |journal=Seminars in Virology |date=February 1997 |volume=8 |issue=1 |pages=65–73 |doi=10.1006/smvy.1997.0107}}</ref>(単一の非コードRNA遺伝子として機能する)に見られる。対照的に、植物は非常に大きなゲノムを持つことがあり<ref>{{cite journal| vauthors = Zonneveld BJ | title=New Record Holders for Maximum Genome Size in Eudicots and Monocots|journal=Journal of Botany|date=2010|volume=2010|pages=1–4|doi=10.1155/2010/527357|doi-access=free}}</ref>、[[イネ]]は46,000を超えるタンパク質コード遺伝子を含んでいる<ref name="pmid11935017">{{cite journal | vauthors = Yu J, Hu S, Wang J, Wong GK, Li S, Liu B, Deng Y, Dai L, Zhou Y, Zhang X, Cao M, Liu J, Sun J, Tang J, Chen Y, Huang X, Lin W, Ye C, Tong W, Cong L, Geng J, Han Y, Li L, Li W, Hu G, Huang X, Li W, Li J, Liu Z, Li L, Liu J, Qi Q, Liu J, Li L, Li T, Wang X, Lu H, Wu T, Zhu M, Ni P, Han H, Dong W, Ren X, Feng X, Cui P, Li X, Wang H, Xu X, Zhai W, Xu Z, Zhang J, He S, Zhang J, Xu J, Zhang K, Zheng X, Dong J, Zeng W, Tao L, Ye J, Tan J, Ren X, Chen X, He J, Liu D, Tian W, Tian C, Xia H, Bao Q, Li G, Gao H, Cao T, Wang J, Zhao W, Li P, Chen W, Wang X, Zhang Y, Hu J, Wang J, Liu S, Yang J, Zhang G, Xiong Y, Li Z, Mao L, Zhou C, Zhu Z, Chen R, Hao B, Zheng W, Chen S, Guo W, Li G, Liu S, Tao M, Wang J, Zhu L, Yuan L, Yang H | display-authors = 6 | title = A draft sequence of the rice genome (Oryza sativa L. ssp. indica) | journal = Science | volume = 296 | issue = 5565 | pages = 79–92 | date = April 2002 | pmid = 11935017 | doi = 10.1126/science.1068037 | s2cid = 208529258 | bibcode = 2002Sci...296...79Y }}</ref>。タンパク質コード遺伝子の総数([[生物圏|地球]]上の[[プロテオーム]])は500万配列と推定されている<ref>{{cite journal | vauthors = Perez-Iratxeta C, Palidwor G, Andrade-Navarro MA | title = Towards completion of the Earth's proteome | journal = EMBO Reports | volume = 8 | issue = 12 | pages = 1135–41 | date = December 2007 | pmid = 18059312 | pmc = 2267224 | doi = 10.1038/sj.embor.7401117 }}</ref>。 |
|||
ヒトゲノムを構成するDNA塩基対の数は1950年代から知られていたが、遺伝子の定義や検出方法の改良に伴い、遺伝子の推定数は時代とともに変化してきた。1960年代から1970年代にかけてのヒト遺伝子の数に関する初期の理論的予測は、変異負荷量の推定値とmRNAの数に基づいており、タンパク質コード遺伝子の数を約30,000個と推定していた<ref>{{cite journal | vauthors = Muller HJ | title = The gene material as the initiator and the organizing basis of life | date = 1966 | journal = American Naturalist | volume = 100 | issue = 915 | pages = 493–517 | doi = 10.1086/282445 | jstor = 2459205 | s2cid = 84202145 | url = http://www.jstor.org/stable/2459205 }}</ref><ref>{{cite journal | vauthors = Ohno S | date = 1972 | title = So much "junk" DNA in our genome | journal = Brookhaven Symposia in Biology | volume = 23 | pages = 366–370| pmid = 5065367 }}</ref><ref>{{cite journal | vauthors = Hatje K, Mühlhausen S, Simm D, Killmar M | title = The Protein-Coding Human Genome: Annotating High-Hanging Fruits. | year = 2019 | journal = BioEssays | volume = 41 | issue = 11 | pages = 1900066 | doi = 10.1002/bies.201900066| pmid = 31544971 | s2cid = 202732556 | doi-access = free }}</ref>。1990年代には、最大で100,000個の遺伝子が推定され、mRNA([[発現配列タグ]])の検出に関する初期のデータは、1980年代に教科書に記述されていた従来の値である30,000遺伝子よりも多いことを示唆していた<ref>{{cite journal | vauthors = Schuler GD, [[:en:Mark Boguski|Boguski MS]], Stewart EA, Stein LD, Gyapay G, Rice K, White RE, Rodriguez-Tomé P, Aggarwal A, Bajorek E, Bentolila S, Birren BB, Butler A, Castle AB, Chiannilkulchai N, Chu A, Clee C, Cowles S, Day PJ, Dibling T, Drouot N, Dunham I, Duprat S, East C, Edwards C, Fan JB, Fang N, Fizames C, Garrett C, Green L, Hadley D, Harris M, Harrison P, Brady S, Hicks A, Holloway E, Hui L, Hussain S, Louis-Dit-Sully C, Ma J, MacGilvery A, Mader C, Maratukulam A, Matise TC, McKusick KB, Morissette J, Mungall A, Muselet D, Nusbaum HC, Page DC, Peck A, Perkins S, Piercy M, Qin F, Quackenbush J, Ranby S, Reif T, Rozen S, Sanders C, She X, Silva J, Slonim DK, Soderlund C, Sun WL, Tabar P, Thangarajah T, Vega-Czarny N, Vollrath D, Voyticky S, Wilmer T, Wu X, Adams MD, Auffray C, Walter NA, Brandon R, Dehejia A, Goodfellow PN, Houlgatte R, Hudson JR, Ide SE, Iorio KR, Lee WY, Seki N, Nagase T, Ishikawa K, Nomura N, Phillips C, Polymeropoulos MH, Sandusky M, Schmitt K, Berry R, Swanson K, Torres R, Venter JC, Sikela JM, Beckmann JS, Weissenbach J, Myers RM, Cox DR, James MR, Bentley D, Deloukas P, Lander ES, Hudson TJ | display-authors = 6 | title = A gene map of the human genome | journal = Science | volume = 274 | issue = 5287 | pages = 540–6 | date = October 1996 | pmid = 8849440 | doi = 10.1126/science.274.5287.540 | s2cid = 22619 | bibcode = 1996Sci...274..540S }}</ref>。 |
|||
ヒトゲノム配列の初期草案は、タンパク質コード遺伝子が約30,000個という初期の予測を裏付けたが、進行中の{{Ill2|GENCODE|en|GENCODE}}アノテーション・プロジェクトによる予測では約19,000個に減少した(2014年)<ref>{{cite journal | vauthors = Chi KR | title = The dark side of the human genome | language = En | journal = Nature | volume = 538 | issue = 7624 | pages = 275–277 | date = October 2016 | pmid = 27734873 | doi = 10.1038/538275a | doi-access = free | bibcode = 2016Natur.538..275C }}</ref><ref>{{Cite journal|last=Ezkurdia|first=Iakes|last2=Juan|first2=David|last3=Rodriguez|first3=Jose Manuel|last4=Frankish|first4=Adam|last5=Diekhans|first5=Mark|last6=Harrow|first6=Jennifer|last7=Vazquez|first7=Jesus|last8=Valencia|first8=Alfonso|last9=Tress|first9=Michael L.|date=2014-11-15|title=Multiple evidence strands suggest that there may be as few as 19 000 human protein-coding genes|url=https://academic.oup.com/hmg/article-lookup/doi/10.1093/hmg/ddu309|journal=Human Molecular Genetics|volume=23|issue=22|pages=5866–5878|language=en|doi=10.1093/hmg/ddu309|issn=0964-6906|pmc=PMC4204768|pmid=24939910}}</ref>。非コード遺伝子の数は確実には分かっていないが、Ensemblプロジェクトによる推定では、26,000個の非コード遺伝子が存在すると示唆されている(2013年)<ref>{{cite web | url= https://useast.ensembl.org/Homo_sapiens/Info/Annotation |title= Human assembly and gene annotation |date= 2022 | website = Ensembl |access-date= 2023-02-28 }}</ref>。 |
|||
=== 必須遺伝子 === |
|||
{{main|{{ill2|必須遺伝子|en|Essential gene}}}} |
|||
[[File:Syn3 genome.svg|thumb|upright=1.35|[[合成生物学|合成生物]] {{Ill2|マイコプラズマ・ラボラトリウム|en|Mycoplasma laboratorium|label=''Syn 3''}}における最小ゲノムの遺伝子機能<ref name = "Hutchison"/>]] |
|||
必須遺伝子とは、生物の生存に不可欠であると考えられる遺伝子のことである<ref>{{cite journal | vauthors = Glass JI, Assad-Garcia N, Alperovich N, Yooseph S, Lewis MR, Maruf M, Hutchison CA, Smith HO, Venter JC | display-authors = 6 | title = Essential genes of a minimal bacterium | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 103 | issue = 2 | pages = 425–30 | date = January 2006 | pmid = 16407165 | pmc = 1324956 | doi = 10.1073/pnas.0510013103 | bibcode = 2006PNAS..103..425G | doi-access = free }}</ref>。この定義は、すべての関連する[[栄養素]]が豊富に利用可能で、環境ストレスがないことを前提としている。生物の遺伝子のごく一部だけが必須である。細菌において、[[大腸菌]]({{Snamei|Escherichia coli}})と[[枯草菌]]({{Snamei|Bacillus subtilis}})に必須な遺伝子は250-400個と推定され、これはその生物の遺伝子の10%未満である<ref>{{cite journal | vauthors = Gerdes SY, Scholle MD, Campbell JW, Balázsi G, Ravasz E, Daugherty MD, Somera AL, Kyrpides NC, Anderson I, Gelfand MS, Bhattacharya A, Kapatral V, D'Souza M, Baev MV, Grechkin Y, Mseeh F, Fonstein MY, Overbeek R, Barabási AL, Oltvai ZN, Osterman AL | display-authors = 6 | title = Experimental determination and system level analysis of essential genes in Escherichia coli MG1655 | journal = Journal of Bacteriology | volume = 185 | issue = 19 | pages = 5673–84 | date = October 2003 | pmid = 13129938 | pmc = 193955 | doi = 10.1128/jb.185.19.5673-5684.2003 }}</ref><ref>{{cite journal | vauthors = Baba T, Ara T, Hasegawa M, Takai Y, Okumura Y, Baba M, Datsenko KA, Tomita M, Wanner BL, Mori H | display-authors = 6 | title = Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection | journal = Molecular Systems Biology | volume = 2 | pages = 2006.0008 | date = 2006 | pmid = 16738554 | pmc = 1681482 | doi = 10.1038/msb4100050 }}</ref><ref name=":0">{{cite journal | vauthors = Juhas M, Reuß DR, Zhu B, Commichau FM | title = Bacillus subtilis and Escherichia coli essential genes and minimal cell factories after one decade of genome engineering | journal = Microbiology | volume = 160 | issue = Pt 11 | pages = 2341–2351 | date = November 2014 | pmid = 25092907 | doi = 10.1099/mic.0.079376-0 | doi-access = free }}</ref>。これらの遺伝子の半分は両方の生物の[[オルソログ]](相同)であり、[[タンパク質合成]]に大きく関与している<ref name=":0" />。[[出芽酵母]]({{Snamei|Saccharomyces cerevisiae}})では、必須遺伝子の数はわずかに多く、1,000遺伝子(生物の遺伝子の約20%)である<ref name="ReferenceA">{{cite journal | vauthors = Tu Z, Wang L, Xu M, Zhou X, Chen T, Sun F | title = Further understanding human disease genes by comparing with housekeeping genes and other genes | journal = BMC Genomics | volume = 7 | pages = 31 | date = February 2006 | pmid = 16504025 | pmc = 1397819 | doi = 10.1186/1471-2164-7-31 | doi-access = free }} {{open access}}</ref>。高等真核生物でその数を測定するのはさらに難しいが、マウスとヒトは約2,000の必須遺伝子があると推定されている(生物の遺伝子の10%程度)<ref name="georgi">{{cite journal | vauthors = Georgi B, Voight BF, Bućan M | title = From mouse to human: evolutionary genomics analysis of human orthologs of essential genes | journal = PLOS Genetics | volume = 9 | issue = 5 | pages = e1003484 | date = May 2013 | pmid = 23675308 | pmc = 3649967 | doi = 10.1371/journal.pgen.1003484 | doi-access = free }} {{open access}}</ref>。合成生物である{{Ill2|マイコプラズマ・ラボラトリウム|en|Mycoplasma laboratorium|label=''Syn 3''}}は、473の必須遺伝子と準必須遺伝子(急速な成長に必要)からなる最小限ゲノムを持っているが、そのうち149は機能不明である<ref name="Hutchison">{{cite journal | vauthors = Hutchison CA, Chuang RY, Noskov VN, Assad-Garcia N, Deerinck TJ, Ellisman MH, Gill J, Kannan K, Karas BJ, Ma L, Pelletier JF, Qi ZQ, Richter RA, Strychalski EA, Sun L, Suzuki Y, Tsvetanova B, Wise KS, Smith HO, Glass JI, Merryman C, Gibson DG, Venter JC | display-authors = 6 | title = Design and synthesis of a minimal bacterial genome | journal = Science | volume = 351 | issue = 6280 | pages = aad6253 | date = March 2016 | pmid = 27013737 | doi = 10.1126/science.aad6253 | doi-access = free | bibcode = 2016Sci...351.....H }}</ref>。 |
|||
必須遺伝子には、{{Ill2|ハウスキーピング遺伝子|en|Housekeeping gene}}(基本的な細胞機能に不可欠<ref>{{cite journal | vauthors = Eisenberg E, Levanon EY | title = Human housekeeping genes, revisited | journal = Trends in Genetics | volume = 29 | issue = 10 | pages = 569–74 | date = October 2013 | pmid = 23810203 | doi = 10.1016/j.tig.2013.05.010 }}</ref>)や、生物の[[発生生物学|発生]]や[[生活環|ライフサイクル]]のさまざまな時期に発現する遺伝子も含まれている<ref>{{cite journal | vauthors = Amsterdam A, Hopkins N | title = Mutagenesis strategies in zebrafish for identifying genes involved in development and disease | journal = Trends in Genetics | volume = 22 | issue = 9 | pages = 473–8 | date = September 2006 | pmid = 16844256 | doi = 10.1016/j.tig.2006.06.011 }}</ref>。ハウスキーピング遺伝子は、比較的一定のレベルで[[構成|構成的]]に[[発現]]するため、[[遺伝子発現]]を分析する際の[[対照群]]として使用される。 |
|||
=== 遺伝子およびゲノムの命名法 === |
|||
[[遺伝子命名法]]は、[[ヒト遺伝子解析機構]]の委員会である{{Ill2|HUGO遺伝子命名法委員会|en|HUGO Gene Nomenclature Committee}}(HGNC)によって、既知のヒト遺伝子ごとに、承認された遺伝子名と[[シンボル]](短縮形[[略語]])の形式で確立されており、HGNCが管理するデータベースを通じてアクセスすることができる。シンボルは一意であるように選ばれ、各遺伝子は1つのシンボルしか持たない(ただし承認されたシンボルが変更されることもある)。シンボルは[[遺伝子ファミリー]]の他のメンバーや、他の生物種(特に[[ハツカネズミ|マウス]]は共通の[[モデル生物]]としての役割を担うため)の{{Ill2|配列相同性|en|Sequence homology|label=相同遺伝子}}と一貫性を保つことが好ましい<ref>{{cite web|title=About the HGNC|url=https://www.genenames.org/about/overview|website=HGNC Database of Human Gene Names|publisher=HUGO Gene Nomenclature Committee|access-date=14 May 2015}}</ref>。 |
|||
== 遺伝子工学 == |
|||
[[File:Breeding transgenesis cisgenesis.svg|thumb|right|upright=1.35|従来の植物育種と{{Ill2|導入遺伝子|en|Transgene|label=トランスジェニック}}および{{Ill2|シスジェネシス|en|Cisgenesis|label=シスジェニック}}遺伝子組換えとの比較。]] |
|||
{{main|遺伝子工学<!-- Genetic engineering -->}} |
|||
遺伝子工学とは、[[バイオテクノロジー]]によって生物の[[ゲノム]]を改変することである。1970年代以来、生物の遺伝子を特異的に追加、削除、編集するための{{Ill2|遺伝子工学技術|en|Genetic engineering techniques|label=さまざまな技術}}が開発されてきた<ref>{{cite journal | vauthors = Cohen SN, Chang AC | title = Recircularization and autonomous replication of a sheared R-factor DNA segment in Escherichia coli transformants | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 70 | issue = 5 | pages = 1293–7 | date = May 1973 | pmid = 4576014 | pmc = 433482 | doi = 10.1073/pnas.70.5.1293 | bibcode = 1973PNAS...70.1293C | doi-access = free }}</ref>。さらに最近開発された[[ゲノム工学]]技術は、人工[[ヌクレアーゼ]]酵素を使用して、[[染色体]]に標的[[DNA修復]]<!-- targeted DNA repair -->を作成し、切断が修復されるときに遺伝子を破壊または編集するものである<ref>{{cite journal | vauthors = Esvelt KM, Wang HH | title = Genome-scale engineering for systems and synthetic biology | journal = Molecular Systems Biology | volume = 9 | issue = 1 | pages = 641 | year = 2013 | pmid = 23340847 | pmc = 3564264 | doi = 10.1038/msb.2012.66 }}</ref><ref>{{cite book | vauthors = Tan WS, Carlson DF, Walton MW, Fahrenkrug SC, Hackett PB | title = Advances in Genetics Volume 80 | chapter = Precision editing of large animal genomes | volume = 80 | pages = 37–97 | year = 2012 | pmid = 23084873 | pmc = 3683964 | doi = 10.1016/B978-0-12-404742-6.00002-8 | isbn = 9780124047426 }}</ref><ref>{{cite journal | vauthors = Puchta H, Fauser F | title = Gene targeting in plants: 25 years later | journal = The International Journal of Developmental Biology | volume = 57 | issue = 6–8 | pages = 629–37 | year = 2013 | pmid = 24166445 | doi = 10.1387/ijdb.130194hp | doi-access = free }}</ref><ref name="ran">{{cite journal | vauthors = Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F | title = Genome engineering using the CRISPR-Cas9 system | journal = Nature Protocols | volume = 8 | issue = 11 | pages = 2281–2308 | date = November 2013 | pmid = 24157548 | pmc = 3969860 | doi = 10.1038/nprot.2013.143 }}</ref>。関連用語の[[合成生物学]]は、生物の広範な遺伝子工学を指すために使用されることがある<ref>{{cite journal | vauthors = Kittleson JT, Wu GC, Anderson JC | title = Successes and failures in modular genetic engineering | journal = Current Opinion in Chemical Biology | volume = 16 | issue = 3–4 | pages = 329–36 | date = August 2012 | pmid = 22818777 | doi = 10.1016/j.cbpa.2012.06.009 }}</ref>。 |
|||
遺伝子工学は今では、[[モデル生物]]を用いた日常的な研究ツールとなっている。たとえば、[[細菌]]に遺伝子を付加することは容易で<ref>{{cite journal | vauthors = Berg P, Mertz JE | title = Personal reflections on the origins and emergence of recombinant DNA technology | journal = Genetics | volume = 184 | issue = 1 | pages = 9–17 | date = January 2010 | pmid = 20061565 | pmc = 2815933 | doi = 10.1534/genetics.109.112144 }}</ref>、特定の遺伝子の機能が破壊された[[ノックアウトマウス]]の系統がその遺伝子の研究に使用されている<ref>{{cite journal | vauthors = Guan C, Ye C, Yang X, Gao J | title = A review of current large-scale mouse knockout efforts | journal = Genesis | volume = 48 | issue = 2 | pages = 73–85 | date = February 2010 | pmid = 20095055 | doi = 10.1002/dvg.20594 | s2cid = 34470273 }}</ref><ref>{{cite journal | vauthors = Austin CP, Battey JF, Bradley A, Bucan M, Capecchi M, Collins FS, Dove WF, Duyk G, Dymecki S, Eppig JT, Grieder FB, Heintz N, Hicks G, Insel TR, Joyner A, Koller BH, Lloyd KC, Magnuson T, Moore MW, Nagy A, Pollock JD, Roses AD, Sands AT, Seed B, Skarnes WC, Snoddy J, Soriano P, Stewart DJ, Stewart F, Stillman B, Varmus H, Varticovski L, Verma IM, Vogt TF, von Melchner H, Witkowski J, Woychik RP, Wurst W, Yancopoulos GD, Young SG, Zambrowicz B | display-authors = 6 | title = The knockout mouse project | journal = Nature Genetics | volume = 36 | issue = 9 | pages = 921–4 | date = September 2004 | pmid = 15340423 | pmc = 2716027 | doi = 10.1038/ng0904-921 | author-link9 = Susan Dymecki }}</ref>。[[農業]]、産業用バイオテクノロジー、[[医学]]への応用のために、多くの生物が[[遺伝子組換え]]されてきた。 |
|||
多細胞生物の場合、通常は[[胚]]が操作されて、遺伝子組換え成体へと成長する<ref name="Deng_2007">{{cite journal | vauthors = Deng C | title = In celebration of Dr. Mario R. Capecchi's Nobel Prize | journal = International Journal of Biological Sciences | volume = 3 | issue = 7 | pages = 417–9 | date = October 2007 | pmid = 17998949 | pmc = 2043165 | doi = 10.7150/ijbs.3.417 }}</ref>。けれども、遺伝子疾患を治療するために、[[遺伝子治療]]技術を用いて成体生物の細胞のゲノムを編集することもできる。 |
|||
== 関連項目 == |
|||
{{Columns-list|colwidth=22em| |
|||
* [[エピジェネティクス]] - DNA塩基配列の変化を伴わない遺伝的形質や細胞機能の安定した変化を研究する学問領域 |
|||
* {{ill2|全ゲノム配列|en|Whole genome sequencing}} - 生物のゲノムのDNA配列のすべて(またはほぼすべて)を一度に決定するプロセス |
|||
* {{ill2|遺伝子中心の進化観|en|Gene-centered view of evolution}} - 利己的遺伝子の理論 |
|||
* {{ill2|遺伝子量|en|Gene dosage}} - ゲノム中に存在する特定の遺伝子のコピー数 |
|||
* [[生物学的特許]] - 生物学分野の発明に関する特許 |
|||
* [[遺伝子プール]] - 集団に含まれるすべての遺伝子の集合 |
|||
* [[遺伝子重剰性]] - ゲノム上に同じ機能を果たす複数の遺伝子が存在すること |
|||
* [[遺伝子サイレンシング]] - 細胞内で遺伝子の発現を制御/阻止すること |
|||
* [[遺伝的アルゴリズム]] - コンピュータサイエンス分野で自然選択から着想を得た解の探索手法 |
|||
* [[ハプロタイプ]] - 単一の親から一緒に受け継がれるアレル群 |
|||
* {{ill2|遺伝子予測ソフトウェアの一覧|en|List of gene prediction software}} |
|||
* {{ill2|ヒト遺伝子の一覧|en|Lists of human genes}} |
|||
* {{ill2|予測医学|en|Predictive medicine}} - 疾病の発生確率を予測し、予防あるいは影響の軽減措置を講じる医学分野 |
|||
* [[量的形質座位]] - 生物集団の表現型形質における量的形質の変異と相関する座位 |
|||
* {{ill2|利己的遺伝因子|en|Selfish genetic element}} - ゲノム内の他の遺伝子を犠牲にして自らの伝達を強化できる遺伝子断片 |
|||
}} |
|||
== 脚注 == |
== 脚注 == |
||
=== 出典 === |
|||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
{{Reflist}} |
{{Reflist}} |
||
== |
=== 情報源 === |
||
; 主要教科書 |
|||
{{参照方法|date=2019年6月|section=1}} |
|||
* {{Cite book|和書 |title=細胞の分子生物学 第6版 |date=2017/9/15 |year=2017 |publisher=ニュートンプレス |author=Bruce Alberts, Alexander Johnson, Julian Lewis, David Morgan, Martin Raff, Keith Roberts, Peter Walter |isbn=978-4315520620 |translator=中村桂子, 松原謙一}} |
|||
* 『細胞の分子生物学』ニュートンプレス - 詳しく知りたい人向け。 |
|||
* {{cite book |vauthors=Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P |author1-link=Bruce Alberts |author3-link=Julian Lewis (biologist) |author4-link=Martin Raff |author6-link=Peter Walter |title=Molecular Biology of the Cell |edition=Fourth |publisher=Garland Science |location=New York |year=2002 |isbn=978-0-8153-3218-3 |url=https://www.ncbi.nlm.nih.gov/books/NBK21054/}} – A molecular biology textbook available free online through NCBI Bookshelf.{{Open access}} |
|||
* 『Lewin 遺伝子』東京化学同人 - 詳しく知りたい人向け。 |
|||
{{Hidden begin |
|||
== 関連項目 == |
|||
|title = [https://www.ncbi.nlm.nih.gov/books/NBK21054/ ''Molecular Biology of the Cell (4th edition)''] の参照した章 (英語) |
|||
{{Wiktionary|遺伝子}} |
|||
|left = true |
|||
* [[致死遺伝子]] |
|||
|bg = #DBE9F4 |
|||
* [[複対立遺伝子]] |
|||
|style = width: 95% |
|||
* [[補足遺伝子]] |
|||
|border = width: 1px; |
|||
* [[抑制遺伝子]] |
|||
border-color:#999999; |
|||
* [[遺伝子組み換え作物]] |
|||
|titlestyle = background: #DBE9F4; |
|||
* [[遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律]](カルタヘナ法) |
|||
padding-left:4px; |
|||
* [[遺伝子検査]] |
|||
}} |
|||
* [[遺伝子診断]] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21052/ Glossary] |
|||
* [[遺伝子治療]] |
|||
* [[遺伝子決定論]] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK26864/ Ch 1: Cells and genomes] |
|||
* [[ヒトゲノム計画]] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26864/ 1.1: The Universal Features of Cells on Earth] |
|||
* [[ハプロタイプ]] |
|||
* [[ナンセンス変異依存mRNA分解機構]] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21068/ Ch 2: Cell Chemistry and Biosynthesis] |
|||
* その他は{{Prefix}}を参照。 |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26883/ 2.1: The Chemical Components of a Cell] |
|||
* {{ill2|遺伝子記憶|en|Genetic memory (psychology)}} - 祖先が経験した内容、学習行動を子孫の遺伝子が記憶しているという説。 |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK26830/ Ch 3: Proteins] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21074/ Ch 4: DNA and Chromosomes] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26821/ 4.1: The Structure and Function of DNA] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26834/ 4.2: Chromosomal DNA and Its Packaging in the Chromatin Fiber] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21064/ Ch 5: DNA Replication, Repair, and Recombination] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26850/ 5.2: DNA Replication Mechanisms] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26879/ 5.4: DNA Repair] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26898/ 5.5: General Recombination] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21050/ Ch 6: How Cells Read the Genome: From DNA to Protein] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26887/ 6.1: DNA to RNA] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26829/ 6.2: RNA to Protein] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21057/ Ch 7: Control of Gene Expression] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26885/ 7.1: An Overview of Gene Control] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26806/ 7.2: DNA-Binding Motifs in Gene Regulatory Proteins] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26872/ 7.3: How Genetic Switches Work] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26890/ 7.5: Posttranscriptional Controls] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26836/ 7.6: How Genomes Evolve] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21063/ Ch 14: Energy Conversion: Mitochondria and Chloroplasts] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26924/ 14.4: The Genetic Systems of Mitochondria and Plastids] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21065/ Ch 18: The Mechanics of Cell Division] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26931/ 18.1: An Overview of M Phase] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26934/ 18.2: Mitosis] |
|||
:[https://www.ncbi.nlm.nih.gov/books/NBK21049/ Ch 20: Germ Cells and Fertilization] |
|||
::[https://www.ncbi.nlm.nih.gov/books/NBK26840/ 20.2: Meiosis] |
|||
{{Hidden end}} |
|||
== 推薦文献 == |
|||
{{refbegin}} |
|||
* {{Cite book|和書 |title=ワトソン遺伝子の分子生物学 第7版 |date=2017/1/20 |year=2017 |publisher=東京電機大学出版局 |author=ジェームス・D・ワトソン 他 |translator=中村桂子 監訳, 滋賀陽子 他訳 |isbn=9784501630300}} |
|||
* {{Cite book|和書 |title=利己的な遺伝子 40周年記念版 |date=2018-02-15 |year=2018 |publisher=紀伊國屋書店 |isbn=978-4314011532 |author=ドーキンス,リチャード |translator=日高敏隆/岸由二/羽田節子/垂水雄二}} |
|||
* {{Cite book|和書 |title=分子細胞生物学 第9版 |date=2023/07/31 |year=2023 |publisher=東京化学同人 |author=H. Lodishほか |translator=堅田利明, 須藤和夫, 山本啓一 |isbn=9784807920518}} |
|||
* {{Cite book|和書 |title=Essential細胞生物学(原書第5版) |date=2021/07/13 |year=2021 |publisher=南江堂 |author=Bruce Alberts, Karen Hopkin, Alexander Johnson, David Morgan, Martin Raff, Keith Roberts, Peter Walter |translator=中村桂子, 松原謙一, 榊佳之, 水島昇 |isbn=978-4-524-22682-5}} |
|||
* {{Cite book|和書 |title=ブラウン 分子遺伝学 [第3版] |date=1999/03/25 |year=1999 |publisher=東京化学同人 |author=T. A. Brown |translator=西郷薫 監訳 |isbn=9784807905010}} |
|||
* {{cite book |vauthors=Ridley M |author-link=Matt Ridley |title=Genome: The Autobiography of a Species in 23 Chapters |publisher=Fourth Estate |year=1999 |isbn=978-0-00-763573-3 |title-link=Genome: The Autobiography of a Species in 23 Chapters|洋書}} |
|||
* {{Cite book |edition=Fifth edition |title=Genomes 5 |publisher=CRC Press, Taylor & Francis Group |date=2023 |location=Boca Raton, FL London New York |isbn=978-0-367-67407-6 |first=Terence A. |last=Brown}} |
|||
{{refend}} |
|||
== 外部リンク == |
== 外部リンク == |
||
{{Wiktionary|遺伝子}} |
|||
* [http://nsgene-lab.jp/gene_main/ 遺伝子の部屋(いでんこのへや)] - いでんこさんと博士の対話形式で進められる遺伝子についての分りやすい解説。NS遺伝子研究室内。 |
|||
{{colbegin|colwidth=27em}} |
|||
* [http://ctdbase.org/ Comparative Toxicogenomics Database] - 米国国立環境健康科学研究所による人間の健康と環境暴露の関係を理解することを目的としたデータベース |
|||
* [http://www.dnaftb.org/ DNA From The Beginning – a primer on genes and DNA] [[コールド・スプリング・ハーバー研究所]]による現代遺伝学の入門書 (英語) |
|||
* [https://www.ncbi.nlm.nih.gov/gene Gene] - [[アメリカ国立生物工学情報センター]]による遺伝子の検索可能なデータベース |
|||
* [http://www.mdpi.com/journal/genes/ ''Genes''] – オープンアクセス専門の出版社[[MDPI]]によるオープンアクセスジャーナル |
|||
* [http://www.mousephenotype.org/ IMPC (International Mouse Phenotyping Consortium)] – 国際マウス表現型解析コンソーシアムによる哺乳類遺伝子機能の百科事典 |
|||
{{colend}} |
|||
{{Gene expression}} |
|||
<!-- |
|||
{{Self-replicating organic structures}} |
|||
--> |
|||
{{Normdaten}} |
{{Normdaten}} |
||
{{DEFAULTSORT:いてんし}} |
|||
{{biosci-stub}} |
|||
[[Category:遺伝子|いでんし]] |
|||
{{DEFAULTSORT:いでんし}} |
|||
[[Category:遺伝学|いでんし]] |
[[Category:遺伝学|いでんし]] |
||
[[Category:分子生物学]] |
[[Category:分子生物学]] |
||
[[Category: |
[[Category:クローニング]] |
||
2024年3月23日 (土) 07:26時点における版
生物学において、遺伝子(いでんし、英: gene、ギリシア語: γένος)という言葉には2つの意味がある。メンデル遺伝子は、遺伝の基本単位である。分子遺伝子は、DNA内のヌクレオチド配列であり、転写されて機能的なRNAを生成する。この分子遺伝子にはタンパク質コード遺伝子と非コード遺伝子の2種類がある[1][2][3][4]。
遺伝子が発現するとき、まずDNAがRNAに転写される。RNAには直接機能するものもあれば、タンパク質合成の中間鋳型となるものもある。
生物の子孫へ遺伝子を伝達することは、ある世代から次の世代へ表現型形質を継承する基礎をなす。これらの遺伝子は、特定の種の集団からなる遺伝子供給源で、個体ごとに特異的な遺伝型と呼ばれるDNA配列を構成する。遺伝型は、環境因子や発達因子とともに、最終的には個体の表現型を決定する。ほとんどの生物学的な形質は、多遺伝子(異なる遺伝子の集合)と遺伝子-環境相互作用が関わる複合的な影響下で発生する。遺伝形質には、花の色や背の高さのようにすぐに分かるものもあれば、血液型や特定の病気のリスク、あるいは生命を構成する何千もの基本的な生化学的過程など、そうでないものもある。
遺伝子はその配列内に変異を獲得し、集団の中でアレルと呼ばれる多様体(変異体)をもたらすことがある。これらのアレルは遺伝子のわずかに異なる改版をコード(符号化)しており、異なる表現型形質を引き起こす可能性がある[5]。遺伝子は自然選択/適者生存とアレルによる遺伝的浮動によって進化する。
遺伝子という用語は、1909年にデンマークの植物学者、植物生理学者、遺伝学者であるウィルヘルム・ヨハンセンによって導入された[6]。これは、子孫や生殖を意味する古代ギリシャ語の γόνος(génos)に由来する[7][8]。
定義
一口に「遺伝子」といっても、遺伝、選択、生物学的機能、あるいは分子構造など、さまざまな側面に基づいて、さまざまな用途で使われているが、これらの定義のほとんどはメンデル遺伝子または分子遺伝子の2つに区分される[1][9][10][11][12]。
メンデル遺伝子(英: Mendelian gene)は遺伝学の古典的な遺伝子であり、あらゆる遺伝性の形質を指す。これはドーキンスの著書『利己的な遺伝子』に記述された遺伝子である[13]。この区分の遺伝子についてのより詳細な議論は、遺伝学と遺伝子中心の進化観の記事を参照のこと。
一方、分子遺伝子(英: molecular gene)の定義は、生化学、分子生物学、そして遺伝学の大部分にわたって、より一般的に使用されており、DNA配列の観点から説明される遺伝子である[1]。この遺伝子にはさまざまな定義があり、その中には誤解を招くものや不正確なものもある[9][14]。
分子遺伝学となったこの分野の非常に初期の研究は、1つの遺伝子が1つのタンパク質を作るという概念を示唆した(もとは「一遺伝子一酵素説」)[15][16]。しかし、1950年代にはリプレッサーRNAを産生する遺伝子が提案され[17]、1960年代の教科書では既に、タンパク質をコードする遺伝子だけでなく、リボソームRNAやtRNAのような機能的RNA分子(非コード遺伝子)を含めた分子遺伝子の定義が用いられるようになった[18]。
「2種類の遺伝子」というこの考え方は、今でもほとんどの教科書で遺伝子の定義の一部となっている。たとえば次のように説明されている。
『ゲノムの主な機能はRNA分子を作り出すことである。DNAヌクレオチド配列の選択された部分が、対応するRNAヌクレオチド配列に複写され、タンパク質をコードするか(mRNAの場合)、あるいはトランスファーRNA(tRNA)やリボソームRNA(rRNA)分子のような「構造的RNA」を形成する。DNAらせんの各領域が、機能的なRNA分子を生成する遺伝子を構成している。』[19]
『遺伝子を「転写されるDNA配列と定義する。この定義には、タンパク質をコードしない遺伝子も含まれる(すべての転写産物がメッセンジャーRNAというわけではない)。この定義では通常、転写を制御してもそれ自体は転写されないゲノムの領域は除外される。この遺伝子の定義に対していくつかの例外が見つかるが、驚くことに、完全に満足のゆく定義は存在しない。』[20]
『遺伝子とは、拡散性の産物をコードするDNA配列である。この産物はタンパク質であったり(大半の遺伝子が該当)、RNAである場合もある(tRNAやrRNAをコードする遺伝子が該当)。重要な特徴は、その産物が合成部位から拡散して、別の場所で作用することである。』[21]
このような定義で重要な部分は(1)遺伝子は転写単位に対応すること、(2)遺伝子はmRNAと非コードRNAの両方を生成すること、(3)調節配列は遺伝子発現を制御するが、遺伝子自体の一部ではないことである。しかし、この定義にはもう一つ重要な部分があり、Kostas Kampourakisの著書「Making Sense of Genes」で強調されている。
『したがって、本書では遺伝子を、タンパク質であれRNA分子であれ、機能的産物の情報をコードするDNA配列として考える。「情報をコードする」とは、DNAの塩基配列が、ある機能を果たすRNA分子やタンパク質を生成するための鋳型として使われるという意味である。』[9]
機能性を強調することが重要なのは、DNAの中には機能的でない転写産物を生成する領域が存在し、それらは遺伝子と見なされないからである。これらには、転写された偽遺伝子のように明白な例だけでなく、転写エラーによってノイズとして生成されるジャンクRNAのような、あまり明白でない例も含まれる。この定義に従うと、真の遺伝子と見なされるためには、その転写物が生物学的機能を持つことが示されなくてはならない[9]。
典型的な遺伝子のサイズに関する初期の推測は、高解像度の遺伝子マッピングとタンパク質やRNA分子のサイズに基づいていた。1965年当時は、1500塩基対という長さが妥当だと考えられた[18]。この数字は、遺伝子は機能性産物の生成に直接関与するDNAであるという考えに基づいていた。1970年代のイントロンの発見は、多くの真核生物の遺伝子が、機能性産物のサイズから推定されるよりもはるかに大きいことを意味した。たとえば、典型的な哺乳類のタンパク質をコードする遺伝子は、長さ(転写領域)が約62,000塩基対で、その数は約20,000個であるため、哺乳類ゲノム(ヒトゲノムを含む)の約35-40%を占める[22][23][24]。
タンパク質コード遺伝子も、非コード遺伝子も、50年以上前から知られているにもかかわらず、遺伝子をタンパク質を特定するDNA配列として定義している教科書、ウェブサイト、科学出版物がいまだに数多く存在している。言い換えれば、その定義はタンパク質コード遺伝子に限定されたものである。次の引用は、アメリカン・サイエンティスト 誌の最近の記事からの一例である。
... de novo遺伝子の潜在的な重要性を真に評価するために、我々はほぼすべての専門家が同意できる「遺伝子」という言葉の厳密な定義に頼った。まず、ヌクレオチド配列が真の遺伝子とみなされるには、オープンリーディングフレーム(ORF)が存在しなければならない。ORFは「遺伝子そのもの」と考えることができる。ORFは、すべての遺伝子に共通する開始マーカーで始まり、3種類ある終了マーカーのうちの1つで終わる。この過程における重要な酵素の一つであるRNAポリメラーゼは、モノレールの列車のようにDNA鎖に沿って走行し、DNAをメッセンジャーRNAの形式に転写する。この点が2つ目の重要な基準である。真の遺伝子とは、転写と翻訳の両方が行われるものをいう。つまり、真の遺伝子は、まず一時的なメッセンジャーRNAを作るための鋳型として使われ、次にそれがタンパク質に翻訳されるものである[25]。
この限定された定義は一般的であり、そのためこの「標準的な定義」を批判し、非コード遺伝子を含む新しい拡張された定義を求める多くの最近の論文が発表されるほどであった[26][27][28]。しかし、このいわゆる「新しい」定義は半世紀以上前から存在しており、現代の一部の著者が非コード遺伝子を無視している理由は定かではない[疑問点]。
一部の定義は他の定義よりも広範に適用できるかもしれないが、生物学の基本的な複雑さは、遺伝子の定義がすべての側面を完璧に捉えることができないことを意味する。すべてのゲノムがDNAであるわけではない(たとえばRNAウイルスを参照)[29]。細菌のオペロンは単一の大きなmRNAに転写される複数のタンパク質コード領域であり、選択的スプライシングは一つのゲノム領域で複数の区域産物をコードすることを可能とし、トランススプライシングによりゲノム全体に分割された短いコード配列からmRNAが連結される[30][31][32]。分子的定義では、イントロン、プロモーター、その他の調節領域などの要素は除外されているため、これらの要素は遺伝子と「関連」し、その機能に影響を与えるものと考えられている。
このような多様で複雑な現象を包含するために、より広範な実用的定義が用いられることもある。この場合、遺伝子は、潜在的に重畳する機能産物がまとまった集まりをコードするゲノム配列の連合体として定義される[33]。この定義は、遺伝子を特定のDNA座位ではなく、その機能的産物(タンパク質またはRNA)によって分類し、調節エレメントは遺伝子関連領域として分類する[33]。
歴史
離散的遺伝単位の発見

離散的遺伝単位(英: discrete inheritable units)の存在は、グレゴール・メンデル(1822-1884)によって初めて提案された[34]。1857年から1864年にかけて、オーストリア帝国のブルノ(現在のチェコ共和国)で、彼は8,000株の一般的な食用エンドウ豆の遺伝パターンを研究し、親から子への明確な形質を追跡した。彼はこれらの遺伝パターンを2n 個の組み合わせとして数学的に説明した(ここで、nは元のエンドウ豆の異なる特徴の数)。彼は遺伝子という言葉は使用しなかったが、観察可能な物理的特徴をもたらす離散的な遺伝単位という観点から自らの結果を説明した。この説明は、ウィルヘルム・ヨハンセンによる遺伝型(生物の遺伝物質)と表現型(その生物の観察可能な形質)の区別を先取りしていた。メンデルはまた、独立組合せ(英: independent assortment)、顕性形質(英: dominant traits)と潜性形質(英: recessive traits)の区別、ヘテロ接合体とホモ接合体の区別、および不連続遺伝の現象を初めて実証した。
メンデルの研究以前は、遺伝の主流は融合遺伝説であり、受精の過程でそれぞれの親が体液を提供し、両親の形質が混ざり合って子孫を残すと考えられていた[35]。チャールズ・ダーウィンは、ギリシャ語のパン(pan、すべて・全体)とジェネシス(genesis、誕生)/ジェノス(genos、起源)を語源とするパンゲネシス(pangenesis、パンゲン説)と呼ばれる遺伝理論を展開した[36][37]。ダーウィンは、ジェミュール(gemmule)という言葉を使って、生殖の際に混ざり合う仮説上の粒子を表現した。
メンデルの研究は1866年に初めて発表されて以来、ほとんど注目されることはなかったが、19世紀後半にユーゴー・ド・フリース、カール・エーリヒ・コレンス、エーリヒ・フォン・チェルマクらによって再発見され、彼らは自らの研究で同様の結論に達した(と主張した)[38]。具体的には、1889年、ユーゴー・ド・フリースは著書『Intracellular Pangenesis(細胞内パンゲネシス)』を出版し[39]、その中で、さまざまな性質が個別の遺伝的キャリアを持ち、生物における特定の形質の継承は粒子で行われると仮定した。ド・フリースは、ダーウィンの1868年のパンゲネシス理論にちなんで、これらの単位をパンゲネス(pangenes、独: pangens)と呼んだ。
20年後の1909年、ウィルヘルム・ヨハンセンが「遺伝子(gene)」という語句を[6]、1906年にはウィリアム・ベイトソンが「遺伝学(genetics)」という語句を導入したが[40][33]、特にエドゥアルト・シュトラスブルガーなどは、依然として遺伝の基本的な物理的/機能的単位に「パンゲン(pangene)」という語句を使用していた[39]:訳者前書き(viii)。
DNAの発見
遺伝子と遺伝に対する理解の進歩は20世紀を通して続いた。1940年代から1950年代の実験によって、デオキシリボ核酸(DNA)が遺伝情報の分子的記憶装置であることが示された[41][42]。DNAの構造は、ロザリンド・フランクリンとモーリス・ウィルキンスによってX線結晶学を使用して研究され、そのことが、ジェームズ・ワトソンとフランシス・クリックが、対になった核酸塩基による遺伝子複製の機構について説得力のある仮説を示す二本鎖DNA分子モデルを発表するきっかけとなった[43][44]。
1950年代初期、染色体内の遺伝子に対する一般的な見解は、糸で繋がれたビーズのように配置された別個の要素のように機能するというものであった。バクテリオファージT4のrII領域に欠損を持つ変異体を用いたベンザーの実験(1955-1959)は、個々の遺伝子が単純な直線構造を持ち、DNAの直線部分に相当する可能性が高いことを示した[45][46]。
この一連の研究により、タンパク質はDNAから転写されたRNAから翻訳されるという分子生物学におけるセントラル・ドグマが確立された。その後、この定説にはレトロウイルスにおける逆転写 (en:英語版) のような例外があることが示されている。DNAレベルでの遺伝学の現代的研究は、分子遺伝学と呼ばれている。
1972年、ウォルター・ファイヤーズと彼のチームは、バクテリオファージMS2のコートタンパク質の遺伝子配列を初めて決定した[47]。その後、1977年に、フレデリック・サンガーによって鎖終結DNAシークエンシング(サンガー法)が開発され、配列決定の効率を向上させる日常的な実験ツールになった[48]。サンガー法の自動化バージョンは、ヒトゲノム計画の初期段階で使用された[49]。
現代的総合とその後継者たち
メンデル遺伝学とダーウィン進化論を統合するために20世紀初頭に開発された理論は、ジュリアン・ハクスリーによって導入された用語で現代的総合(英: modern synthesis)と呼ばれている[50]。
このような進化観は、ジョージ・C・ウィリアムズの遺伝子中心の進化観によって強調された。彼は、メンデル遺伝子を「認識できる頻度で分離し、組み換わるもの」と定義し、それは自然選択の選択単位(生物学的組織の階層における生物学的実体)であると提案した[51]:24。メンデル遺伝子の中心性と進化における自然選択の重要性を強調する関連した考えは、リチャード・ドーキンスによって広められた[13]。
1960年代後半に進化中立説が発展したことで、無作為な遺伝的浮動が進化における主要な担い手であり、中立説は分子進化の帰無仮説とあるべきという認識につながった[52]。これが系統樹の構築と、DNA配列を使用したすべての年代測定技術の基礎となる分子時計の開発につながった。これらの技術は分子遺伝子の配列に限定されるものではなく、ゲノムのすべてのDNAセグメントに適用することができる。
分子基盤

DNA
大半の生物は、DNA(デオキシリボ核酸)の長い鎖にその遺伝子をコード化(符号化)している。DNAは、4種類のヌクレオチドサブユニットからなる鎖で構成されており、それぞれのサブユニットは、五炭糖(2-デオキシリボース)、リン酸基、そしてアデニン、シトシン、グアニン、チミンの4塩基のうちの1つから構成されている[53]:2.1。
DNAの2本の鎖が互いにねじり合わさってDNA二重らせんを形成し、リン酸-糖主鎖が外側をらせん状に回り、塩基は内側に向いてアデニンはチミンと、グアニンはシトシンと塩基対をなしている。塩基対形成による特異性は、アデニンとチミンが2本の水素結合を形成するのに対し、シトシンとグアニンは3本の水素結合を形成することから生じる。したがって、二重らせんの2本の鎖は相補的でなければならず、一方の鎖のアデニンともう一方の鎖のチミンが対になるように、またグアニンとシトシンも同様に、塩基の配列が一致していなければならない:4.1[53]。
塩基のペントース残基の化学組成に起因して、DNA鎖には方向性が生じる。DNAポリマーの一端には、デオキシリボース上に露出したヒドロキシ基があり、これは分子の3'末端と呼ばれている。もう一方の末端には露出したリン酸基があり、これは5'末端と呼ばれる。二重らせんの2本の鎖は反対方向に走っている。DNAの複製や転写を含む核酸合成は5'→3'方向に行われるが、その理由は、露出した3'-ヒドロキシを求核剤とした脱水反応によって新しいヌクレオチドが付加されるからである[54]:27.2。
DNAにコードされた遺伝子の発現は、遺伝子をRNAに転写することから始まる。RNAはDNAと非常によく似た構造を持っている第二の核酸であるが、そのモノマーはデオキシリボースではなくリボース糖を含んでいる。また、RNAには、チミンの代わりにウラシル塩基も含まれている。RNA分子はDNAよりも安定性が低く、一般的に一本鎖で存在する。タンパク質をコードする遺伝子は、コドンと呼ばれる3連のヌクレオチド配列で構成されており、遺伝子の「言語」における「単語」として役割を果たす。遺伝暗号は、タンパク質が翻訳される際のコドンとアミノ酸との対応関係を規定する。遺伝暗号はすべての既知の生物でほぼ同じである[53]:4.1。
染色体


生物体または細胞内の遺伝子の総体をゲノムといい、1本または複数の染色体に保存することができる。染色体は、単一の非常に長いDNAらせんで、その内部には数千もの遺伝子がコード化されている[53]:4.2。特定の遺伝子が存在する染色体の領域を座位(または遺伝子座)と呼ぶ。各座位には遺伝子のアレル(英: allele、対立遺伝子)が1つずつ存在するが、集団のメンバーの中にはその座位に異なるアレルが存在し、遺伝子の配列がわずかに異なる場合がある。
真核生物の遺伝子の大部分は、一連の大きな線状染色体に保存されている。染色体は、ヒストンと呼ばれる貯蔵タンパク質と複合体となって核内に詰め込まれ、ヌクレオソームと呼ばれる単位を形成する。このようにパッケージ化されて凝縮したDNAはクロマチンと呼ばれる[53]:4.2。DNAがヒストン上に保存される方法や、ヒストン自体の化学的修飾によって、DNAの特定の領域が遺伝子発現に利用可能かどうかが調節される。遺伝子に加えて、真核生物の染色体には、細胞分裂の際にDNAが末端領域を分解することなく複製され、娘細胞に確実に振り分けられるようにするための配列、すなわち複製起点、テロメア、セントロメアが含まれている[53]:4.2。複製起点は、染色体の2つの複製を作成するためにDNA複製が開始される配列領域である。テロメアは、線状染色体の末端を覆う長い反復配列で、DNA複製時にコーディング領域や調節領域の分解を防ぐ役割を担う。テロメアの長さはゲノムが複製されるたびに短縮し、老化プロセスに関与していると考えられている[56]。セントロメアは、細胞分裂の際に姉妹染色分体を娘細胞に分離する紡錘糸を結合するために必要である[53]:18.2。
原核生物(細菌と古細菌)は通常、一本の大きな環状染色体にゲノムを格納している。同様に、真核生物の細胞小器官の中には、少数の遺伝子を含む残余の環状染色体を持つものもある[53]:14.4。原核生物は、プラスミドと呼ばれる小さな環状DNAで染色体を補うことがある。プラスミドは通常、少数の遺伝子しかコードしておらず、個体間で転移可能である。たとえば、抗生物質耐性の遺伝子は通常、細菌のプラスミド上にコードされており、遺伝子の水平伝播によって、(たとえ異なる種の細胞間であっても)個々の細胞間で受け継ぐことができる[57]。
原核生物の染色体が比較的、遺伝子密度が高いのに対し、真核生物の染色体は明らかな機能を持たないDNA領域を含むことがよくある。単細胞の単純な真核生物にはこのようなDNAは比較的少ないが、ヒトを含む複雑な多細胞生物のゲノムには、機能が特定されていないDNAが絶対的に多く含まれている[58]。このDNAはしばしば「ジャンクDNA」と呼ばれてきた。しかし、より最近の分析によると、タンパク質をコードするDNAはヒトゲノムの2%を占めるに過ぎないものの、ゲノム中の塩基の約80%が発現している可能性があるため、ジャンクDNAという言葉は誤用である可能性が示唆されている[30]。
構造と機能
構造
|
|
タンパク質コード遺伝子は多くの要素から構成されており、実際のタンパク質コード配列は多くの場合、そのごく一部にしか過ぎない。これらには、成熟mRNAのイントロンや非翻訳領域が含まれる。非コード遺伝子にもイントロンが含まれることがあり、それらは機能的の成熟RNAを産生する過程で除去される。
すべての遺伝子は、その発現に必要な調節配列と関連付けられている。まず、遺伝子にはプロモーター配列が必要である。プロモーターは転写因子によって認識・結合される。転写因子はさらにRNAポリメラーゼを動員して、その領域に結合して転写を開始するのを助ける[53]:7.1。この認識は通常、TATAボックスのようなコンセンサス配列として行われる。遺伝子は複数のプロモーターを持つことができ、その結果、5'末端の長さが異なるメッセンジャーRNA(mRNA)が生成する[60]。高度転写遺伝子は、転写因子と強い結合を形成する「強い」プロモーター配列があり、それによって転写が高速に開始される。他の遺伝子は、転写因子との結合が弱く、転写を開始する頻度が低い「弱い」プロモーターを持っている[53]:7.2。真核生物のプロモーター領域は、原核生物のプロモーターよりもはるかに複雑で、同定するのは難しい[53]:7.3。
さらに遺伝子は、発現を変化させる調節領域が、その遺伝子の何1,000塩基も上流または下流に存在することがある。これらの領域は転写因子と結合することによって作用し、DNAをループさせて、調節配列(および結合した転写因子)がRNAポリメラーゼ結合部位に近づくようにする[61]。たとえば、エンハンサーはアクチベータータンパク質と結合することで転写を増加させ、RNAポリメラーゼをプロモーターに動員するのを助ける。逆にサイレンサーはリプレッサータンパク質と結合し、DNAがRNAポリメラーゼに利用されにくくする[62]。
タンパク質コード遺伝子から産生される成熟メッセンジャーRNAの両端には、リボソーム、RNA結合タンパク質、マイクロRNA、ターミネーター、開始・終止コドンなどの結合部位を含む非翻訳領域がある[63]。さらに、ほとんどの真核生物のオープンリーディングフレームには、RNAスプライシングという過程で除去される非翻訳イントロンと、一緒に連結されるエクソンが含まれている。最後に、遺伝子転写産物の末端が切断およびポリアデニル化(CPA)部位によって規定され、そこで新たに生成されたpre-mRNAが切断され、約200個のアデノシン一リン酸が3'末端に付加される。ポリ(A)テールは成熟mRNAを分解から保護し、翻訳、局在化、および核からの転写物の輸送に影響する役割を持つ。スプライシングと、それに続くポリアデニル化により、タンパク質またはRNA産物をコードする最終的な成熟mRNAが生成する[64]。ヒト遺伝子の位置を決定する一般的な機構は知られているが、これらの細胞プロセスを調節する正確な因子を同定することは、活発な研究分野である。たとえば、3'-UTRにおける既知の配列特徴では、ヒト遺伝子末端の半分しか説明できない[65]。
真核生物の非コード遺伝子の多くは、異なる転写終結機構を持ち、ポリ(A)テールを持たない。
原核生物の遺伝子の多くは、いくつかのタンパク質コード遺伝子が一団として転写されるオペロンに組織化されている[66][67]。オペロン内の遺伝子は、ポリシストロン型mRNAと呼ばれる連続したメッセンジャーRNAとして転写される。この文脈でのシストロンという用語は遺伝子に相当する。オペロンのmRNAへの転写は、多くの場合、特定の代謝産物の存在によって活性化または不活性するリプレッサーによって制御される[68]。リプレッサーが活性化すると、オペレーター領域と呼ばれるオペロンの先頭にあるDNA配列に結合し、オペロンの転写を抑制する。逆にリプレッサーが不活性化した場合、オペロンの転写を起こすことができるようになる(たとえば、lacオペロンを参照)。オペロン遺伝子の産物は通常、関連した機能を持ち、同じ遺伝子制御ネットワークに関与している[53]:7.3。
複雑性
多くの遺伝子は単純な構造を持っているが、生物学の多くと同様に、非常に複雑な構造をしていたり、珍しい極端な例を示すものもある。真核生物の遺伝子は、しばしばエクソンよりもはるかに大きなイントロンを持ち[69][70]、これらのイントロンは他の遺伝子を内包することさえある[71]。関連するエンハンサーは、何1,000塩基も離れていたり、あるいは、2つの染色体間の物理的接触を介して作用する、まったく別の染色体上に存在することさえある[72][73]。一つの遺伝子が選択的スプライシングによって複数の異なる機能的産物をコードすることもできるし、逆に一つの遺伝子が染色体間をまたがって分割しても、それらの転写産物はトランススプライシングによって再び機能的配列に連結される[74]。また、オーバーラップ遺伝子が、DNA配列の一部を、反対側の鎖上または同じ鎖上(異なるリーディングフレーム、あるいは同じリーディングフレーム)で共有することも可能である[75]。
遺伝子発現
すべての生物において、遺伝子のDNAにコードされた情報を読み取り、それによって規定されるタンパク質を生成するためには、2つの段階を経る必要がある。まず、遺伝子のDNAがメッセンジャーRNA(mRNA)に転写される[53]:6.1。次に、そのmRNAがタンパク質に翻訳される[53]:6.2。RNAコード遺伝子の場合は、最初の段階を経なくてはならないが、タンパク質には翻訳されない[76]。RNAやタンパク質のように、生物学的に機能する分子を産生する過程は遺伝子発現と呼ばれ、その結果として生じる分子は遺伝子産物と呼ばれる。
遺伝暗号

遺伝子のDNAのヌクレオチド配列は、遺伝暗号を通じてタンパク質のアミノ酸配列を規定する。コドンと呼ばれる三連のヌクレオチドの集合は、それぞれが特定のアミノ酸に対応している[53]:6。DNAの3つの連続した塩基が各アミノ酸をコードするという原理は、1961年にバクテリオファージT4のrIIB遺伝子のフレームシフト変異を使用して実証された[77](クリック-ブレナーらの実験を参照)。
さらに、1つの「開始コドン」と3種類の「終止コドン」がタンパク質コード領域の開始と終了を示す。64種類のコドンが可能で(3つの位置に4種のヌクレオチドで43通りの組合せが可能)、標準的なアミノ酸は20種類しかない。したがってコードは冗長であり、複数のコドンが同じアミノ酸を指定することができる。コドンとアミノ酸の対応は、既知のすべての生物においてほぼ共通である[78]。
転写
転写により、メッセンジャーRNAと呼ばれる一本鎖RNA分子が生成する。そのヌクレオチド配列は、転写元のDNAと相補的である[53]:6.1。mRNAは、DNA遺伝子とその最終産物であるタンパク質との中間体として機能する。遺伝子のDNAを鋳型として相補的なmRNAが生成される。mRNAは、鋳型鎖と相補的に合成されるため、遺伝子のDNAコード鎖の配列と一致する。転写はRNAポリメラーゼと呼ばれる酵素によって行われ、鋳型鎖を3'から5'の方向に読み取り、RNAを5'から3'の方向に合成する。転写を開始するために、ポリメラーゼがまず遺伝子のプロモーター領域を認識して結合する。したがって遺伝子調節の主要な機構は、ポリメラーゼを物理的に遮断するリプレッサー分子による強固な結合か、プロモーター領域に接近できないようにDNAを組織化することにより、プロモーター領域を遮断または隔離することである[53]:7。
原核生物では、転写は細胞質で行われる。非常に長い転写産物の場合、RNAの3'末端が転写されている間に、RNAの5'末端から翻訳が始まることがある。真核生物では、転写は細胞のDNAが保存されている核で行われる。ポリメラーゼによって生成されたRNA分子は一次転写産物と呼ばれ、翻訳のために細胞質に輸送される前に転写後修飾を受ける。こうした修飾の一つに、転写領域にあるタンパク質をコードしない配列であるイントロンのスプライシング(除去)がある。選択的スプライシング機構により、同じ遺伝子から異なる配列を持つ(したがって異なるタンパク質をコードする)成熟転写産物が生成することもある。これは真核細胞における調節の主要な形態であり、一部の原核生物でも見られる[53]:7.5[79]。
翻訳

翻訳は、成熟mRNAを鋳型として、新しいタンパク質を合成する過程である[53]:6.2。翻訳は、RNAとタンパク質からなる大きな複合体であるリボソームによって行われ、これはペプチド結合を形成することで、伸長するポリペプチド鎖に新しいアミノ酸を付加する化学反応を行う役割を担っている。遺伝暗号は、トランスファーRNA(tRNA)と呼ばれる特殊なRNA分子との相互作用を通じて、コドンと呼ばれる単位で一度に3塩基ずつ読み取られる。それぞれのtRNAは、mRNA上で読み取られるコドンと相補的なアンチコドンという3つの不対塩基を持っている。また、tRNAは相補的コドンによって指定されるアミノ酸とも共有結合している。tRNAがmRNA鎖の相補的コドンに結合すると、リボソームはそのアミノ酸を新しいポリペプチド鎖に結合させ、ポリペプチド鎖がアミノ末端からカルボキシル末端まで合成される。合成中および合成後も、ほとんどの新しいタンパク質はその細胞機能を発揮する前に、活性を持った三次元構造に折り畳まれなければならない[53]:3。
調節
遺伝子の発現は限られた資源を利用するので、その産物が必要な時だけ発現が行われるように調節されている[53]:7。細胞は、その外部環境(利用可能な栄養素、温度、その他のストレス)、その内部環境(細胞分裂周期、代謝、感染状態など)、および多細胞生物であればその特定の役割に応じて遺伝子発現を調節する。遺伝子発現は、転写の開始からRNAプロセシング、タンパク質の翻訳後修飾に至るまで、あらゆる段階で制御することができる。大腸菌における乳糖代謝遺伝子の調節(lacオペロン)は、1961年に初めて報告されたそうした機構である[80]。
RNA遺伝子
典型的なタンパク質コード遺伝子は、最終タンパク質産物の生成過程における中間体として、まずRNAに転写される[53]:6.1。また、リボソームRNAやトランスファーRNAの合成のように、RNA分子が実際の機能産物となる場合もある。リボザイムとして知られるRNAの中には酵素機能を持つものもあれば、マイクロRNAやリボスイッチのように制御的な役割を持つものもある。このようなRNAが転写されるDNA配列は、非コードRNA遺伝子として知られている[76]。
ウイルスの中には、ゲノム全体をRNAの形で保存し、DNAをまったく含まないものもある[81][82]。遺伝子の保存にRNAを使用するため、宿主細胞は感染するとすぐに、転写を待つことなくタンパク質を合成することができる[83]。対照的に、HIVのようなRNAレトロウイルスは、タンパク質が合成される前に、ゲノムをRNAからDNAに逆転写する必要がある。
遺伝

生物は両親から遺伝子を受け継ぐ。無性生物は、親のゲノムの完全な写しを継承するだけである。有性生物は、それぞれの親から完全な染色体を1セットずつ継承するので、各染色体の写しを2つ持っている[53]:1。
メンデル遺伝
メンデル遺伝によれば、生物の表現型(観察可能な身体的/行動的特徴)の変異は、遺伝型(特定の遺伝子の集合)の変異に部分的に起因している。各遺伝子は特定の表現型形質を規定し、遺伝子の異なる配列(アレル)が異なる表現型を引き起こす。ほとんどの真核生物(メンデルが研究したエンドウ豆の植物など)は、それぞれの形質ごとに2つのアレルを持ち、それぞれの親から1つずつ受け継がれる[53]:20。
座位(遺伝子座とも)におけるアレルには顕性アレルと潜性アレルがあり、顕性アレルは同じ形質について他のどのアレルとも対になっても対応する表現型を生じるが、潜性アレルは同じアレルと対になったときにのみ表現型を生じる。もし生物の遺伝型がわかっていれば、どのアレルが顕性で、どのアレルが潜性かを決定することができる。たとえば、エンドウの高い背丈を規定するアレルが、低い背丈を規定するアレルより顕性であれば、一方の親から背丈の高いアレルを、他方の親から背丈の低いアレルを受け継いだエンドウも高い背丈を持つことになる。メンデルの研究は、配偶子(生殖細胞)の生成においてアレルが独立に組み入れられて、次世代における変異が保証されることを示した。メンデル遺伝は、単一遺伝子によって決定される多くの形質(よく知られた遺伝性疾患の多くを含む)に対して、依然として優れたモデルであるが、DNA複製と細胞分裂の物理的過程は含まれていない[84][85]。
DNA複製と細胞分裂
生物の成長、発達、繁殖は細胞分裂に依存している。細胞分裂とは、一つの細胞が(通常は同等の)二つの娘細胞に分裂する過程である。そのためにはまず、DNA複製と呼ばれる過程で、ゲノム中のすべての遺伝子の写しを作る必要がある[53]:5.2。複製はDNAポリメラーゼと呼ばれる特殊な酵素によって行われ、二重らせんDNAの一方の鎖(鋳型鎖という)を「読み取り」、新しい相補鎖を合成する。DNAの二重らせんは塩基対を形成して相互に結合されているため、一方の鎖の塩基配列はその相補鎖の塩基配列を明確に規定する。したがって、正確な写しを作るためには、一方の鎖だけを酵素が読み取ればよい。DNA複製の過程は半保存的であり、各娘細胞に受け継がれるゲノムの2本のDNA鎖には、元のDNA鎖と新しく合成されたDNA鎖が1つずつ含まれている[53]:5.2。
生きた細胞におけるDNA複製の速度は、ファージに感染した大腸菌におけるファージT4 DNAの伸長速度で初めて測定され、驚くほど速いことがわかった[86]。37 °Cでの指数関数的なDNA増加期間において、伸長速度は749ヌクレオチド/秒であった。
DNA複製が完了すると、細胞はゲノムの2つの写しを物理的に分離し、2つの異なる膜結合した細胞に分裂しなければならない[53]:18.2。原核生物(細菌と古細菌)では、これは通常、二分裂と呼ばれる比較的単純な過程で行われる。二分裂では、それぞれの環状ゲノムが細胞膜に付着し、細胞膜が陥入して細胞質を2つの膜結合部分に分割するときに娘細胞に分離される。二分裂は、真核生物の細胞分裂の速度と比べると極めて速い。真核生物の細胞分裂は、細胞周期として知られるより複雑な過程を経て行われる。DNAの複製は、細胞周期のS期という段階で起こり、染色体の分離と細胞質の分裂はM期で起こる[53]:18.1。
分子遺伝
ある世代の細胞から次の世代の細胞への遺伝物質の複製と伝達は、分子遺伝の基礎であり、遺伝子の古典的な像と分子的な像との接点でもある。生物が両親の特徴を受け継ぐのは、子孫の細胞には両親のそれぞれの細胞に由来する遺伝子の写しが含まれているからである。無性生殖をする生物では、子孫は親の遺伝的複製あるいはクローンとなる。有性生殖をする生物では、減数分裂と呼ばれる特殊な細胞分裂によって、配偶子または生殖細胞と呼ばれる単数体、すなわち各遺伝子の写しを1つだけ含む細胞が作られる[53]:20.2。雌性(しせい)配偶子は卵または卵子と呼ばれ、雄性(ゆうせい)配偶子は精細胞または精子と呼ばれる。2つの配偶子が融合して二倍体の受精卵が形成される。受精卵は、2組の遺伝子を持つ単一の細胞であり、それぞれの遺伝子の写しは母親から1つ、父親から1つである[53]:20。
減数分裂の細胞分裂の過程で、遺伝的組換え、あるいは乗換えと呼ばれる現象が起こることがある。この現象では、一方の染色分体上のDNA断片が、対応する相同な非姉妹染色分体上のDNA断片と入れ替わる。この結果、アレルが再集合する可能性がある[53]:5.5。メンデルの独立組合せの法則は、両親の各形質に関する2つの遺伝子が、それぞれ独立して配偶子に組み入れられるというもので、ある形質について生物がどのアレルを受け継ぐかは、別の形質についてどのアレルを受け継ぐかとは無関係である。実際には、このことは、同じ染色体上に存在しない遺伝子、あるいは同じ染色体上で互いに非常に離れた位置にある遺伝子にのみ当てはまる。2つの遺伝子が同じ染色体上で近くに存在するほど、配偶子においてより密接に関連し、一緒に現れる頻度も高くなる(遺伝的連鎖と呼ばれる)[87]。互いに非常に近い遺伝子は、その間に交叉(こうさ)点が生じる可能性が極めて低いため、基本的に分離することはない[87]。
分子進化
変異
DNAの複製は、ほとんどの場合非常に正確であるが、変異(突然変異とも)と呼ばれるエラーが起こることもある[53]:7.6。真核細胞におけるエラー率は、1回の複製につきヌクレオチドあたり10−8と低いこともあるが[88][89]、一部のRNAウイルスでは10−3と高いことがある[90]。このことは、ヒトゲノムの場合、世代ごとに約30個の新しい変異が蓄積されることを意味する[91]。小さな変異は、DNA複製やDNA損傷の結果として引き起こされる場合があり、単一の塩基が変更される点変異や、単一の塩基が挿入または欠失するフレームシフト変異が含まれる。これらの変異はいずれも、ミスセンス(コドンを変更して別のアミノ酸をコードする)またはナンセンス(途中で終止コドンが生じる)によって遺伝子を変化させる場合がある[92]。より大きな変異は、組換えエラーによって引き起こされる可能性があり、染色体の大きな部分の重複、欠失、再配列または逆位などの染色体異常が生じる。さらに、DNA修復機構が分子の物理的損傷を修復する際に変異エラーを引き起こすこともある。生存という観点においては、変異があっても修復する方が(たとえば二本鎖切断の修復)、正確な写しを復元するよりも重要である[53]:5.4。
ある種の集団において、複数の異なる遺伝子のアレルが存在する場合、その遺伝子は多型と呼ばれる。ほとんどの異なるアレルは機能的に同等であるが、アレルの中には異なる表現型形質を引き起こすこともある。遺伝子の最も一般的なアレルは野生型と呼ばれ、稀なアレルは変異体と呼ばれる。集団内における異なるアレル頻度の遺伝的変異は、自然選択と遺伝的浮動の両方によるものである[93]。野生型アレルは、必ずしも稀なアレルの祖先であるとは限らないし、より適応しているとも限らない。
遺伝子内の変異のほとんどは中立で、生物の表現型に影響を与えない(サイレント変異)。複数のコドンが同じアミノ酸をコードするため、アミノ酸配列が変化しない変異もある(同義置換)。その他の変異には中立的なものもあり、たとえば保存的置換は、アミノ酸配列が変化しても、タンパク質が新しいアミノ酸でも同様に機能する。しかし、多くの変異は有害または致死的であり、自然選択によって集団から取り除かれる。遺伝性疾患は有害突然変異の結果であり、罹患者(りかんじゃ)の自然変異が原因で起こることもあれば、遺伝することもある。最後に、ごく一部の変異は生物の適応を向上させる有益なものであり、その定方向選択が適応進化をもたらすため、進化にとって極めて重要である[53]:7.6。
配列相同性
遺伝子間の関係は、DNAの配列を比較することによって測定することができる。類似性の程度が最低線を上回れば、その遺伝子は共通の祖先の子孫であると結論づけることができる。それらは相同であるという[94][95]。共通の祖先からの直接の子孫によって関連している遺伝子はオルソロガス遺伝子であり、それらは通常、異なる種の同じ座位に見いだされる。遺伝子重複の結果として関連する遺伝子はパラロガス遺伝子と呼ばれる[96][97]。
オルソロガス遺伝子の機能は、パラロガス遺伝子よりも類似しているとしばしば考えられるが、その違いはわずかである[98][99]。
新しい遺伝子の起源
真核生物の系統において、新しい遺伝子が生まれる最も一般的な原因は、ゲノム上に存在する遺伝子のコピー数に変異が起こる遺伝子重複である[100][101]。この結果として生じる遺伝子(パラログ)は、配列や機能が分岐する可能性がある。このようにして形成された遺伝子の集合が遺伝子ファミリーを構成する。ファミリー内での遺伝子の重複や消失は一般的で、進化における生物多様性の重要な要因となっている[102]。遺伝子重複の結果、ある遺伝子の複製が機能しなくなることや、機能する複製が変異を受けて機能を失うこともある。このような機能しない遺伝子は偽遺伝子と呼ばれる[53]:7.6。
オーファン遺伝子は、その配列が既存の遺伝子と類似性を示さないもので、遺伝子重複よりも稀である。ヒトゲノムには、ヒト以外の生物で同定可能な相同遺伝子を持たない遺伝子が18個-60個含まれていると推定されている[103][104]。オーファン遺伝子は主に、以前は非コード配列であったものから出現したde novo遺伝子か、あるいは遺伝子重複の後に急速に配列が変化して元の関係が検出できなくなったもののいずれかとして生じる[105]。de novo遺伝子は一般的に、ほとんどの真核生物遺伝子よりも短く単純な構造をしており、イントロンはあったとしてもほとんどない[100]。長い進化の過程においては、de novo遺伝子の誕生が、分類学的に制限された遺伝子ファミリーのかなりの部分に関与している可能性がある[106]。
遺伝子の水平伝播とは、生殖以外の機構による遺伝物質の伝達を指す。この機構は、原核生物において新しい遺伝子が生まれる一般的な原因であり、遺伝子重複よりも遺伝的変異により多く寄与していると考えられることもある[107]。これは、抗生物質耐性、病原性、適応的代謝機能を広めるための一般的な手段である[57][108]。遺伝子の水平伝播は真核生物では稀であるが、原生生物や藻類のゲノムでは、細菌の遺伝子が含まれている可能性が高い例が同定されている[109][110]。
ゲノム
ゲノムは生物の遺伝物質の全体であり、遺伝子と非コード配列の両方を含む[111]。真核生物の遺伝子の構造や機能を分析するために、アノテーション(注釈)をするFINDERなどのツールが使用される[112]。
遺伝子数

ゲノムの大きさと、それがコードする遺伝子の数は、生物によって大きく異なる。最も小さなゲノムはウイルス[121]やウイロイド[122](単一の非コードRNA遺伝子として機能する)に見られる。対照的に、植物は非常に大きなゲノムを持つことがあり[123]、イネは46,000を超えるタンパク質コード遺伝子を含んでいる[117]。タンパク質コード遺伝子の総数(地球上のプロテオーム)は500万配列と推定されている[124]。
ヒトゲノムを構成するDNA塩基対の数は1950年代から知られていたが、遺伝子の定義や検出方法の改良に伴い、遺伝子の推定数は時代とともに変化してきた。1960年代から1970年代にかけてのヒト遺伝子の数に関する初期の理論的予測は、変異負荷量の推定値とmRNAの数に基づいており、タンパク質コード遺伝子の数を約30,000個と推定していた[125][126][127]。1990年代には、最大で100,000個の遺伝子が推定され、mRNA(発現配列タグ)の検出に関する初期のデータは、1980年代に教科書に記述されていた従来の値である30,000遺伝子よりも多いことを示唆していた[128]。
ヒトゲノム配列の初期草案は、タンパク質コード遺伝子が約30,000個という初期の予測を裏付けたが、進行中のGENCODEアノテーション・プロジェクトによる予測では約19,000個に減少した(2014年)[129][130]。非コード遺伝子の数は確実には分かっていないが、Ensemblプロジェクトによる推定では、26,000個の非コード遺伝子が存在すると示唆されている(2013年)[131]。
必須遺伝子
必須遺伝子とは、生物の生存に不可欠であると考えられる遺伝子のことである[133]。この定義は、すべての関連する栄養素が豊富に利用可能で、環境ストレスがないことを前提としている。生物の遺伝子のごく一部だけが必須である。細菌において、大腸菌(Escherichia coli)と枯草菌(Bacillus subtilis)に必須な遺伝子は250-400個と推定され、これはその生物の遺伝子の10%未満である[134][135][136]。これらの遺伝子の半分は両方の生物のオルソログ(相同)であり、タンパク質合成に大きく関与している[136]。出芽酵母(Saccharomyces cerevisiae)では、必須遺伝子の数はわずかに多く、1,000遺伝子(生物の遺伝子の約20%)である[137]。高等真核生物でその数を測定するのはさらに難しいが、マウスとヒトは約2,000の必須遺伝子があると推定されている(生物の遺伝子の10%程度)[138]。合成生物であるSyn 3は、473の必須遺伝子と準必須遺伝子(急速な成長に必要)からなる最小限ゲノムを持っているが、そのうち149は機能不明である[132]。
必須遺伝子には、ハウスキーピング遺伝子(基本的な細胞機能に不可欠[139])や、生物の発生やライフサイクルのさまざまな時期に発現する遺伝子も含まれている[140]。ハウスキーピング遺伝子は、比較的一定のレベルで構成的に発現するため、遺伝子発現を分析する際の対照群として使用される。
遺伝子およびゲノムの命名法
遺伝子命名法は、ヒト遺伝子解析機構の委員会であるHUGO遺伝子命名法委員会(HGNC)によって、既知のヒト遺伝子ごとに、承認された遺伝子名とシンボル(短縮形略語)の形式で確立されており、HGNCが管理するデータベースを通じてアクセスすることができる。シンボルは一意であるように選ばれ、各遺伝子は1つのシンボルしか持たない(ただし承認されたシンボルが変更されることもある)。シンボルは遺伝子ファミリーの他のメンバーや、他の生物種(特にマウスは共通のモデル生物としての役割を担うため)の相同遺伝子と一貫性を保つことが好ましい[141]。
遺伝子工学
遺伝子工学とは、バイオテクノロジーによって生物のゲノムを改変することである。1970年代以来、生物の遺伝子を特異的に追加、削除、編集するためのさまざまな技術が開発されてきた[142]。さらに最近開発されたゲノム工学技術は、人工ヌクレアーゼ酵素を使用して、染色体に標的DNA修復を作成し、切断が修復されるときに遺伝子を破壊または編集するものである[143][144][145][146]。関連用語の合成生物学は、生物の広範な遺伝子工学を指すために使用されることがある[147]。
遺伝子工学は今では、モデル生物を用いた日常的な研究ツールとなっている。たとえば、細菌に遺伝子を付加することは容易で[148]、特定の遺伝子の機能が破壊されたノックアウトマウスの系統がその遺伝子の研究に使用されている[149][150]。農業、産業用バイオテクノロジー、医学への応用のために、多くの生物が遺伝子組換えされてきた。
多細胞生物の場合、通常は胚が操作されて、遺伝子組換え成体へと成長する[151]。けれども、遺伝子疾患を治療するために、遺伝子治療技術を用いて成体生物の細胞のゲノムを編集することもできる。
関連項目
- エピジェネティクス - DNA塩基配列の変化を伴わない遺伝的形質や細胞機能の安定した変化を研究する学問領域
- 全ゲノム配列 - 生物のゲノムのDNA配列のすべて(またはほぼすべて)を一度に決定するプロセス
- 遺伝子中心の進化観 - 利己的遺伝子の理論
- 遺伝子量 - ゲノム中に存在する特定の遺伝子のコピー数
- 生物学的特許 - 生物学分野の発明に関する特許
- 遺伝子プール - 集団に含まれるすべての遺伝子の集合
- 遺伝子重剰性 - ゲノム上に同じ機能を果たす複数の遺伝子が存在すること
- 遺伝子サイレンシング - 細胞内で遺伝子の発現を制御/阻止すること
- 遺伝的アルゴリズム - コンピュータサイエンス分野で自然選択から着想を得た解の探索手法
- ハプロタイプ - 単一の親から一緒に受け継がれるアレル群
- 遺伝子予測ソフトウェアの一覧
- ヒト遺伝子の一覧
- 予測医学 - 疾病の発生確率を予測し、予防あるいは影響の軽減措置を講じる医学分野
- 量的形質座位 - 生物集団の表現型形質における量的形質の変異と相関する座位
- 利己的遺伝因子 - ゲノム内の他の遺伝子を犠牲にして自らの伝達を強化できる遺伝子断片
脚注
出典
- ^ a b c “The "Mendelian Gene" and the "Molecular Gene": Two Relevant Concepts of Genetic Units”. Current Topics in Developmental Biology 119: 1–26. (2016). doi:10.1016/bs.ctdb.2016.03.002. PMID 27282022.
- ^ “What is a gene?: MedlinePlus Genetics”. MedlinePlus (2020年9月17日). 2021年1月4日閲覧。
- ^ The new dictionary of cultural literacy. Boston: Houghton Mifflin. (2002). ISBN 0-618-22647-8. OCLC 50166721
- ^ “Studying Genes”. nigms.nih.gov. 2021年1月15日閲覧。
- ^ “Genetic terminology”. Statistical Human Genetics. Methods in Molecular Biology. 850. Humana Press. (2012). pp. 1–9. doi:10.1007/978-1-61779-555-8_1. ISBN 978-1-61779-554-1. PMC 4450815. PMID 22307690
- ^ a b (German) Elemente der exakten Erblichkeitslehre [Elements of the exact theory of heredity]. Jena, Germany: Gustav Fischer. (1909). p. 124 From p. 124: "Dieses "etwas" in den Gameten bezw. in der Zygote, … – kurz, was wir eben Gene nennen wollen – bedingt sind." (This "something" in the gametes or in the zygote, which has crucial importance for the character of the organism, is usually called by the quite ambiguous term Anlagen [primordium, from the German word Anlage for "plan, arrangement ; rough sketch"]. Many other terms have been suggested, mostly unfortunately in closer connection with certain hypothetical opinions. The word "pangene", which was introduced by Darwin, is perhaps used most frequently in place of Anlagen. However, the word "pangene" was not well chosen, as it is a compound word containing the roots pan (the neuter form of Πας all, every) and gen (from γί-γ(ε)ν-ομαι, to become). Only the meaning of this latter [i.e., gen] comes into consideration here ; just the basic idea – [namely,] that a trait in the developing organism can be determined or is influenced by "something" in the gametes – should find expression. No hypothesis about the nature of this "something" should be postulated or supported by it. For that reason it seems simplest to use in isolation the last syllable gen from Darwin's well-known word, which alone is of interest to us, in order to replace, with it, the poor, ambiguous word Anlage. Thus we will say simply "gene" and "genes" for "pangene" and "pangenes". The word gene is completely free of any hypothesis ; it expresses only the established fact that in any case many traits of the organism are determined by specific, separable, and thus independent "conditions", "foundations", "plans" – in short, precisely what we want to call genes.)
- ^ “1909: The Word Gene Coined”. genome.gov. 2021年3月8日閲覧。 "...Wilhelm Johannsen coined the word gene to describe the Mendelian units of heredity..."
- ^ “What is genomic medicine?”. Journal of the Medical Library Association (University Library System, University of Pittsburgh) 107 (3): 442–448. (July 2019). doi:10.5195/jmla.2019.604. PMC 6579593. PMID 31258451.
- ^ a b c d Making Sense of Genes. Cambridge, UK: Cambridge University Press. (2017)
- ^ “Definition of historical models of gene function and their relation to students' understanding of genetics”. Science & Education 16 (7–8): 849–881. (5 December 2006). Bibcode: 2007Sc&Ed..16..849G. doi:10.1007/s11191-006-9064-4.
- ^ “Stanford Encyclopedia of Philosophy: Gene”. Stanford Encyclopedia of Philosophy (2022年). 2023年2月28日閲覧。
- ^ “Defining functional DNA elements in the human genome”. Proceedings of the National Academy of Sciences of the United States of America 111 (17): 6131–8. (April 2014). Bibcode: 2014PNAS..111.6131K. doi:10.1073/pnas.1318948111. PMC 4035993. PMID 24753594.
- ^ a b ドーキンス,リチャード 著、日高敏隆/岸由二/羽田節子/垂水雄二 訳『利己的な遺伝子 40周年記念版』紀伊國屋書店、2018年2月15日。ISBN 978-4314011532。
- ^ “Genes: Philosophical Analyses Put to the Test”. History and Philosophy of the Life Sciences 26 (1): 5–28. (2004). doi:10.1080/03919710412331341621. JSTOR 23333378. PMID 15791804.
- ^ “Genetic Control of Biochemical Reactions in Neurospora”. Proceedings of the National Academy of Sciences of the United States of America 27 (11): 499–506. (November 1941). Bibcode: 1941PNAS...27..499B. doi:10.1073/pnas.27.11.499. PMC 1078370. PMID 16588492.
- ^ “A centennial: George W. Beadle, 1903-1989”. Genetics 166 (1): 1–10. (January 2004). doi:10.1534/genetics.166.1.1. PMC 1470705. PMID 15020400.
- ^ The Eight Day of Creation (Expanded ed.). Plainview, NY (US): Cold Spring Harbor Laboratory Press. (1996)
- ^ a b Molecular Biology of the Gene. New York, NY, US: W.A. Benjamin, Inc.. (1965)
- ^ Molecular Biology of the Cell: Third Edition. London, UK: Garland Publishing, Inc.. (1994). ISBN 0-8153-1619-4
- ^ Principles of Biochemistry: Fifth Edition. Upper Saddle River, NJ, US: Pearson. (2012)
- ^ Genes VIII. Upper Saddle River, NJ, US: Pearson/Prentice Hall. (2004)
- ^ “On the length, weight and GC content of the human genome”. BMC Research Notes 12 (1): 106–173. (2019). doi:10.1186/s13104-019-4137-z. PMC 6391780. PMID 30813969.
- ^ “Mammalian Introns: When the Junk Generates Molecular Diversity”. International Journal of Molecular Sciences 16 (3): 4429–4452. (2015). doi:10.3390/ijms16034429. PMC 4394429. PMID 25710723.
- ^ “Similar ratios of introns to intergenic sequence across animal genomes”. Genome Biology and Evolution 9 (6): 1582–1598. (2017). doi:10.1093/gbe/evx103. PMC 5534336. PMID 28633296.
- ^ “Turning Junk into Us: How Genes Are Born”. American Scientist 109: 174–182. (2021).
- ^ “The Evolving Definition of a Gene: With the discovery that nearly all of the genome is transcribed, the definition of a "gene" needs another revision”. BioScience 59: 928–931. (2009). doi:10.1525/bio.2009.59.11.3.
- ^ “What Is a Gene?”. Nature 441 (7092): 399–401. (2006). Bibcode: 2006Natur.441..398P. doi:10.1038/441398a. PMID 16724031.
- ^ “DNA study forces rethink of what it means to be a gene”. Science 316 (5831): 1556–1557. (2007). doi:10.1126/science.316.5831.1556. PMID 17569836.
- ^ . Eric Delwart, Luis Enjuanes“Origins and Evolution of the Global RNA Virome”. mBio 9 (6): e02329–18. (November 2018). doi:10.1128/mBio.02329-18. PMC 6282212. PMID 30482837.
- ^ a b “Genomics. DNA study forces rethink of what it means to be a gene”. Science 316 (5831): 1556–7. (June 2007). doi:10.1126/science.316.5831.1556. PMID 17569836.
- ^ “Mitochondrial DNA as a genomic jigsaw puzzle”. Science (AAAS) 318 (5849): 415. (October 2007). Bibcode: 2007Sci...318..415M. doi:10.1126/science.1148033. PMID 17947575.
- ^ “Tandem chimerism as a means to increase protein complexity in the human genome”. Genome Research 16 (1): 37–44. (January 2006). doi:10.1101/gr.4145906. PMC 1356127. PMID 16344564.
- ^ a b c “What is a gene, post-ENCODE? History and updated definition”. Genome Research 17 (6): 669–81. (June 2007). doi:10.1101/gr.6339607. PMID 17567988.
- ^ “Genes and causation”. Philosophical Transactions. Series A, Mathematical, Physical, and Engineering Sciences 366 (1878): 3001–15. (September 2008). Bibcode: 2008RSPTA.366.3001N. doi:10.1098/rsta.2008.0086. PMID 18559318.
- ^ “Blending Inheritance - an overview | ScienceDirect Topics”. 2021年7月3日閲覧。
- ^ "genesis". Oxford English Dictionary (3rd ed.). Oxford University Press. September 2005. (要購読、またはイギリス公立図書館への会員加入。)
- ^ A History of the Life Sciences (Third ed.). Marcel Dekker, CRC Press. (2002). p. 371. ISBN 978-0-203-91100-6
- ^ The Monk in the Garden: The Lost and Found Genius of Gregor Mendel, the Father of Genetics. Boston: Houghton Mifflin. (2000). pp. 1–9. ISBN 978-0395-97765-1
- ^ a b (ドイツ語) Intracellulare Pangenese [Intracellular Pangenesis]. Jena: Verlag von Gustav Fischer. (1889) Translated in 1908 from German to English by Open Court Publishing Co., Chicago, 1910
- ^ “The progress of genetic research”. Report of the Third International Conference 1906 on Genetics. London, England: Royal Horticultural Society. (1906). pp. 90–97. "… the science itself [i.e. the study of the breeding and hybridisation of plants] is still nameless, and we can only describe our pursuit by cumbrous and often misleading periphrasis. To meet this difficulty I suggest for the consideration of this Congress the term Genetics, which sufficiently indicates that our labors are devoted to the elucidation of the phenomena of heredity and variation: in other words, to the physiology of Descent, with implied bearing on the theoretical problems of the evolutionist and the systematist, and application to the practical problems of breeders, whether of animals or plants."
- ^ “Studies on the Chemical Nature of the Substance Inducing Transformation of Pneumococcal Types : Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated From Pneumococcus Type III”. The Journal of Experimental Medicine 79 (2): 137–58. (February 1944). doi:10.1084/jem.79.2.137. PMC 2135445. PMID 19871359. Reprint: “Studies on the chemical nature of the substance inducing transformation of pneumococcal types. Inductions of transformation by a desoxyribonucleic acid fraction isolated from pneumococcus type III”. The Journal of Experimental Medicine 149 (2): 297–326. (February 1979). doi:10.1084/jem.149.2.297. PMC 2184805. PMID 33226.
- ^ “Independent functions of viral protein and nucleic acid in growth of bacteriophage”. The Journal of General Physiology 36 (1): 39–56. (May 1952). doi:10.1085/jgp.36.1.39. PMC 2147348. PMID 12981234.
- ^ The Eighth Day of Creation: Makers of the Revolution in Biology. Cold Spring Harbor Laboratory Press. (1979). pp. 51–169. ISBN 978-0-87969-477-7
- ^ “Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid”. Nature 171 (4356): 737–8. (April 1953). Bibcode: 1953Natur.171..737W. doi:10.1038/171737a0. PMID 13054692.
- ^ “Fine Structure of a Genetic Region in Bacteriophage”. Proceedings of the National Academy of Sciences of the United States of America 41 (6): 344–54. (June 1955). Bibcode: 1955PNAS...41..344B. doi:10.1073/pnas.41.6.344. PMC 528093. PMID 16589677.
- ^ “On the Topology of the Genetic Fine Structure”. Proceedings of the National Academy of Sciences of the United States of America 45 (11): 1607–20. (November 1959). Bibcode: 1959PNAS...45.1607B. doi:10.1073/pnas.45.11.1607. PMC 222769. PMID 16590553.
- ^ “Nucleotide sequence of the gene coding for the bacteriophage MS2 coat protein”. Nature 237 (5350): 82–8. (May 1972). Bibcode: 1972Natur.237...82J. doi:10.1038/237082a0. PMID 4555447.
- ^ “DNA sequencing with chain-terminating inhibitors”. Proceedings of the National Academy of Sciences of the United States of America 74 (12): 5463–7. (December 1977). Bibcode: 1977PNAS...74.5463S. doi:10.1073/pnas.74.12.5463. PMC 431765. PMID 271968.
- ^ “DNA Sequencing Technologies”. Nature Education Knowledge. SciTable (Nature Publishing Group) 1 (1): 193. (2008).
- ^ Evolution: the Modern Synthesis. Cambridge, Massachusetts: MIT Press. (1942). ISBN 978-0262513661
- ^ Adaptation and Natural Selection a Critique of Some Current Evolutionary Thought (Online ed.). Princeton: Princeton University Press. (2001). ISBN 9781400820108
- ^ “Neutral Theory: The Null Hypothesis of Molecular Evolution”. Nature Education 1: 218. (2008).
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Molecular Biology of the Cell (Fourth ed.). New York: Garland Science. (2002). ISBN 978-0-8153-3218-3
- ^ Biochemistry (5th ed.). San Francisco: W.H. Freeman. (2002). ISBN 978-0-7167-4955-4
- ^ “Three-dimensional maps of all chromosomes in human male fibroblast nuclei and prometaphase rosettes”. PLOS Biology 3 (5): e157. (May 2005). doi:10.1371/journal.pbio.0030157. PMC 1084335. PMID 15839726.

- ^ “Oncogene-induced senescence: putting the brakes on tumor development”. Cancer Research 66 (6): 2881–4. (March 2006). doi:10.1158/0008-5472.CAN-05-4006. PMID 16540631.
- ^ a b “Plasmid encoded antibiotic resistance: acquisition and transfer of antibiotic resistance genes in bacteria”. British Journal of Pharmacology 153 (Suppl 1): S347-57. (March 2008). doi:10.1038/sj.bjp.0707607. PMC 2268074. PMID 18193080.
- ^ International Human Genome Sequencing Consortium (October 2004). “Finishing the euchromatic sequence of the human genome”. Nature 431 (7011): 931–45. Bibcode: 2004Natur.431..931H. doi:10.1038/nature03001. PMID 15496913.
- ^ a b Shafee, Thomas; Lowe, Rohan (2017). “Eukaryotic and prokaryotic gene structure”. WikiJournal of Medicine 4 (1). doi:10.15347/wjm/2017.002. ISSN 2002-4436.
- ^ “Mapping and quantifying mammalian transcriptomes by RNA-Seq”. Nature Methods 5 (7): 621–8. (July 2008). doi:10.1038/nmeth.1226. PMID 18516045.
- ^ “Enhancers: five essential questions”. Nature Reviews. Genetics 14 (4): 288–95. (April 2013). doi:10.1038/nrg3458. PMC 4445073. PMID 23503198.
- ^ “Transcriptional regulatory elements in the human genome”. Annual Review of Genomics and Human Genetics 7: 29–59. (2006). doi:10.1146/annurev.genom.7.080505.115623. PMID 16719718.
- ^ “Untranslated regions of mRNAs”. Genome Biology 3 (3): REVIEWS0004. (2002-02-28). doi:10.1186/gb-2002-3-3-reviews0004. PMC 139023. PMID 11897027.
- ^ “Introns in UTRs: why we should stop ignoring them”. BioEssays 34 (12): 1025–34. (December 2012). doi:10.1002/bies.201200073. PMID 23108796.
- ^ “Known sequence features explain half of all human gene ends”. NAR Genomics and Bioinformatics 5 (2): lqad031. (April 2023). doi:10.1093/nargab/lqad031. PMC 10072996. PMID 37035540.
- ^ “Operons in Escherichia coli: genomic analyses and predictions”. Proceedings of the National Academy of Sciences of the United States of America 97 (12): 6652–7. (June 2000). Bibcode: 2000PNAS...97.6652S. doi:10.1073/pnas.110147297. PMC 18690. PMID 10823905.
- ^ “Operons in eukaryotes”. Briefings in Functional Genomics & Proteomics 3 (3): 199–211. (November 2004). doi:10.1093/bfgp/3.3.199. PMID 15642184.
- ^ “Genetic regulatory mechanisms in the synthesis of proteins”. Journal of Molecular Biology 3 (3): 318–56. (June 1961). doi:10.1016/S0022-2836(61)80072-7. PMID 13718526.
- ^ “Intron size in mammals: complexity comes to terms with economy”. Trends in Genetics 23 (1): 20–24. (January 2007). doi:10.1016/j.tig.2006.10.003. PMID 17070957.
- ^ “Intron size and exon evolution in Drosophila”. Genetics 170 (1): 481–485. (May 2005). doi:10.1534/genetics.104.037333. PMC 1449718. PMID 15781704.
- ^ “An overview of nested genes in eukaryotic genomes”. Eukaryotic Cell 8 (9): 1321–1329. (September 2009). doi:10.1128/EC.00143-09. PMC 2747821. PMID 19542305..
- ^ “Interchromosomal associations between alternatively expressed loci”. Nature 435 (7042): 637–645. (June 2005). Bibcode: 2005Natur.435..637S. doi:10.1038/nature03574. PMID 15880101.
- ^ “Interchromosomal association and gene regulation in trans”. Trends in Genetics 26 (4): 188–197. (April 2010). doi:10.1016/j.tig.2010.01.007. PMC 2865229. PMID 20236724.
- ^ “Evolutionary Insights into RNA trans-Splicing in Vertebrates”. Genome Biology and Evolution 8 (3): 562–577. (March 2016). doi:10.1093/gbe/evw025. PMC 4824033. PMID 26966239.
- ^ “Overlapping genes in natural and engineered genomes”. Nature Reviews. Genetics 23 (3): 154–168. (March 2022). doi:10.1038/s41576-021-00417-w. PMC 8490965. PMID 34611352.
- ^ a b “Non-coding RNA genes and the modern RNA world”. Nature Reviews. Genetics 2 (12): 919–29. (December 2001). doi:10.1038/35103511. PMID 11733745.
- ^ “General nature of the genetic code for proteins”. Nature 192 (4809): 1227–32. (December 1961). Bibcode: 1961Natur.192.1227C. doi:10.1038/1921227a0. PMID 13882203.
- ^ “The genetic code”. Scientific American (WH Freeman and Company) 207 (4): 66–74. (October 1962). Bibcode: 1962SciAm.207d..66C. doi:10.1038/scientificamerican1062-66. PMID 13882204.
- ^ “Ironing out the kinks: splicing and translation in bacteria”. Genes & Development 12 (9): 1243–7. (May 1998). doi:10.1101/gad.12.9.1243. PMID 9573040.
- ^ “Genetic regulatory mechanisms in the synthesis of proteins”. Journal of Molecular Biology 3 (3): 318–56. (June 1961). doi:10.1016/S0022-2836(61)80072-7. PMID 13718526.
- ^ “Evolution and taxonomy of positive-strand RNA viruses: implications of comparative analysis of amino acid sequences”. Critical Reviews in Biochemistry and Molecular Biology 28 (5): 375–430. (January 1993). doi:10.3109/10409239309078440. PMID 8269709.
- ^ “RNA Virus Genomes”. eLS. (2001). doi:10.1002/9780470015902.a0001488.pub2. ISBN 978-0470016176.
- ^ “Basic concepts in RNA virus evolution”. FASEB Journal 10 (8): 859–64. (June 1996). doi:10.1096/fasebj.10.8.8666162. PMID 8666162.
- ^ “Gregor Mendel and the Principles of Inheritance”. Nature Education Knowledge. SciTable (Nature Publishing Group) 1 (1): 134. (2008).
- ^ “Mendelian Genetics: Patterns of Inheritance and Single-Gene Disorders”. Nature Education Knowledge. SciTable (Nature Publishing Group) 1 (1): 63. (2008).
- ^ “DNA elongation rates and growing point distributions of wild-type phage T4 and a DNA-delay amber mutant”. Journal of Molecular Biology 106 (4): 963–81. (October 1976). doi:10.1016/0022-2836(76)90346-6. PMID 789903.
- ^ a b “Discovery and Types of Genetic Linkage”. Nature Education Knowledge. SciTable (Nature Publishing Group) 1 (1): 139. (2008).
- ^ “Estimate of the mutation rate per nucleotide in humans”. Genetics 156 (1): 297–304. (September 2000). doi:10.1093/genetics/156.1.297. PMC 1461236. PMID 10978293.
- ^ “Analysis of genetic inheritance in a family quartet by whole-genome sequencing”. Science 328 (5978): 636–9. (April 2010). Bibcode: 2010Sci...328..636R. doi:10.1126/science.1186802. PMC 3037280. PMID 20220176.
- ^ “Rates of spontaneous mutation”. Genetics 148 (4): 1667–86. (April 1998). doi:10.1093/genetics/148.4.1667. PMC 1460098. PMID 9560386.
- ^ Pyeritz, Reed E., Bruce R. Korf, and Wayne W. Grody, eds. Emery and Rimoin’s principles and practice of medical genetics and genomics: foundations. Academic Press, 2018.
- ^ “What kinds of gene mutations are possible?”. Genetics Home Reference. United States National Library of Medicine (2015年5月11日). 2015年5月19日閲覧。
- ^ “Natural Selection, Genetic Drift, and Gene Flow Do Not Act in Isolation in Natural Populations”. Nature Education Knowledge. SciTable (Nature Publishing Group) 3 (10): 5. (2010).
- ^ “Homology in classical and molecular biology”. Molecular Biology and Evolution 5 (6): 603–25. (November 1988). doi:10.1093/oxfordjournals.molbev.a040523. PMID 3065587.
- ^ Molecular and Genome Evolution. Sunderland MA (US): Sinauer Associates, Inc.. (2016). ISBN 9781605354699
- ^ Molecular and Genome Evolution. Sunderland MA (US): Sinauer Associates, Inc.. (2016). ISBN 9781605354699
- ^ “Orthologs and paralogs - we need to get it right”. Genome Biology 2 (8): INTERACTIONS1002. (2001). doi:10.1186/gb-2001-2-8-interactions1002. PMC 138949. PMID 11532207.
- ^ “How confident can we be that orthologs are similar, but paralogs differ?”. Trends in Genetics 25 (5): 210–6. (May 2009). doi:10.1016/j.tig.2009.03.004. PMID 19368988.
- ^ “Resolving the ortholog conjecture: orthologs tend to be weakly, but significantly, more similar in function than paralogs”. PLOS Computational Biology 8 (5): e1002514. (2012). Bibcode: 2012PLSCB...8E2514A. doi:10.1371/journal.pcbi.1002514. PMC 3355068. PMID 22615551.

- ^ a b “De novo origins of human genes”. PLOS Genetics 7 (11): e1002381. (November 2011). doi:10.1371/journal.pgen.1002381. PMC 3213182. PMID 22102832.

- ^ “Mechanisms of gene duplication and amplification”. Cold Spring Harbor Perspectives in Biology 7 (2): a016592. (February 2015). doi:10.1101/cshperspect.a016592. PMC 4315931. PMID 25646380.
- ^ “The evolution of mammalian gene families”. PLOS ONE 1 (1): e85. (December 2006). Bibcode: 2006PLoSO...1...85D. doi:10.1371/journal.pone.0000085. PMC 1762380. PMID 17183716.

- ^ “Recent de novo origin of human protein-coding genes”. Genome Research 19 (10): 1752–9. (October 2009). doi:10.1101/gr.095026.109. PMC 2765279. PMID 19726446.
- ^ “De novo origin of human protein-coding genes”. PLOS Genetics 7 (11): e1002379. (November 2011). doi:10.1371/journal.pgen.1002379. PMC 3213175. PMID 22102831.

- ^ “New genes from non-coding sequence: the role of de novo protein-coding genes in eukaryotic evolutionary innovation”. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences 370 (1678): 20140332. (September 2015). doi:10.1098/rstb.2014.0332. PMC 4571571. PMID 26323763.
- ^ “Phylogenetic patterns of emergence of new genes support a model of frequent de novo evolution”. BMC Genomics 14 (1): 117. (February 2013). doi:10.1186/1471-2164-14-117. PMC 3616865. PMID 23433480.
- ^ “Horizontal transfer, not duplication, drives the expansion of protein families in prokaryotes”. PLOS Genetics 7 (1): e1001284. (January 2011). doi:10.1371/journal.pgen.1001284. PMC 3029252. PMID 21298028.

- ^ “Lateral gene transfer and the nature of bacterial innovation”. Nature 405 (6784): 299–304. (May 2000). Bibcode: 2000Natur.405..299O. doi:10.1038/35012500. PMID 10830951.
- ^ “Horizontal gene transfer in eukaryotic evolution”. Nature Reviews. Genetics 9 (8): 605–18. (August 2008). doi:10.1038/nrg2386. PMID 18591983.
- ^ “Gene transfer from bacteria and archaea facilitated evolution of an extremophilic eukaryote”. Science 339 (6124): 1207–10. (March 2013). Bibcode: 2013Sci...339.1207S. doi:10.1126/science.1231707. PMID 23471408.
- ^ Ridley, M. (2006). Genome. New York, NY: Harper Perennial. ISBN 0-06-019497-9
- ^ “FINDER: an automated software package to annotate eukaryotic genes from RNA-Seq data and associated protein sequences”. BMC Bioinformatics 44 (9): e89. (Apr 2021). doi:10.1186/s12859-021-04120-9. PMC 8056616. PMID 33879057.
- ^ Watson, JD, Baker TA, Bell SP, Gann A, Levine M, Losick R. (2004). "Ch9-10", Molecular Biology of the Gene, 5th ed., Peason Benjamin Cummings; CSHL Press.
- ^ “Integr8 – A.thaliana Genome Statistics”. 2015年4月26日閲覧。
- ^ “Understanding the Basics”. The Human Genome Project. 2015年4月26日閲覧。
- ^ “WS227 Release Letter”. WormBase (2011年8月10日). 2013年11月28日時点のオリジナルよりアーカイブ。2013年11月19日閲覧。
- ^ a b “A draft sequence of the rice genome (Oryza sativa L. ssp. indica)”. Science 296 (5565): 79–92. (April 2002). Bibcode: 2002Sci...296...79Y. doi:10.1126/science.1068037. PMID 11935017.
- ^ “Sequence and organization of the human mitochondrial genome”. Nature 290 (5806): 457–65. (April 1981). Bibcode: 1981Natur.290..457A. doi:10.1038/290457a0. PMID 7219534.
- ^ “The genome sequence of Drosophila melanogaster”. Science 287 (5461): 2185–95. (March 2000). Bibcode: 2000Sci...287.2185.. doi:10.1126/science.287.5461.2185. PMID 10731132.
- ^ “Between a chicken and a grape: estimating the number of human genes”. Genome Biology 11 (5): 206. (2010). doi:10.1186/gb-2010-11-5-206. PMC 2898077. PMID 20441615.
- ^ “Sequences from ancestral single-stranded DNA viruses in vertebrate genomes: the parvoviridae and circoviridae are more than 40 to 50 million years old”. Journal of Virology 84 (23): 12458–62. (December 2010). doi:10.1128/JVI.01789-10. PMC 2976387. PMID 20861255.
- ^ “Viroids: The Noncoding Genomes”. Seminars in Virology 8 (1): 65–73. (February 1997). doi:10.1006/smvy.1997.0107.
- ^ “New Record Holders for Maximum Genome Size in Eudicots and Monocots”. Journal of Botany 2010: 1–4. (2010). doi:10.1155/2010/527357.
- ^ “Towards completion of the Earth's proteome”. EMBO Reports 8 (12): 1135–41. (December 2007). doi:10.1038/sj.embor.7401117. PMC 2267224. PMID 18059312.
- ^ “The gene material as the initiator and the organizing basis of life”. American Naturalist 100 (915): 493–517. (1966). doi:10.1086/282445. JSTOR 2459205.
- ^ “So much "junk" DNA in our genome”. Brookhaven Symposia in Biology 23: 366–370. (1972). PMID 5065367.
- ^ “The Protein-Coding Human Genome: Annotating High-Hanging Fruits.”. BioEssays 41 (11): 1900066. (2019). doi:10.1002/bies.201900066. PMID 31544971.
- ^ “A gene map of the human genome”. Science 274 (5287): 540–6. (October 1996). Bibcode: 1996Sci...274..540S. doi:10.1126/science.274.5287.540. PMID 8849440.
- ^ “The dark side of the human genome” (英語). Nature 538 (7624): 275–277. (October 2016). Bibcode: 2016Natur.538..275C. doi:10.1038/538275a. PMID 27734873.
- ^ Ezkurdia, Iakes; Juan, David; Rodriguez, Jose Manuel; Frankish, Adam; Diekhans, Mark; Harrow, Jennifer; Vazquez, Jesus; Valencia, Alfonso et al. (2014-11-15). “Multiple evidence strands suggest that there may be as few as 19 000 human protein-coding genes” (英語). Human Molecular Genetics 23 (22): 5866–5878. doi:10.1093/hmg/ddu309. ISSN 0964-6906. PMC PMC4204768. PMID 24939910.
- ^ “Human assembly and gene annotation”. Ensembl (2022年). 2023年2月28日閲覧。
- ^ a b “Design and synthesis of a minimal bacterial genome”. Science 351 (6280): aad6253. (March 2016). Bibcode: 2016Sci...351.....H. doi:10.1126/science.aad6253. PMID 27013737.
- ^ “Essential genes of a minimal bacterium”. Proceedings of the National Academy of Sciences of the United States of America 103 (2): 425–30. (January 2006). Bibcode: 2006PNAS..103..425G. doi:10.1073/pnas.0510013103. PMC 1324956. PMID 16407165.
- ^ “Experimental determination and system level analysis of essential genes in Escherichia coli MG1655”. Journal of Bacteriology 185 (19): 5673–84. (October 2003). doi:10.1128/jb.185.19.5673-5684.2003. PMC 193955. PMID 13129938.
- ^ “Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: the Keio collection”. Molecular Systems Biology 2: 2006.0008. (2006). doi:10.1038/msb4100050. PMC 1681482. PMID 16738554.
- ^ a b “Bacillus subtilis and Escherichia coli essential genes and minimal cell factories after one decade of genome engineering”. Microbiology 160 (Pt 11): 2341–2351. (November 2014). doi:10.1099/mic.0.079376-0. PMID 25092907.
- ^ “Further understanding human disease genes by comparing with housekeeping genes and other genes”. BMC Genomics 7: 31. (February 2006). doi:10.1186/1471-2164-7-31. PMC 1397819. PMID 16504025.

- ^ “From mouse to human: evolutionary genomics analysis of human orthologs of essential genes”. PLOS Genetics 9 (5): e1003484. (May 2013). doi:10.1371/journal.pgen.1003484. PMC 3649967. PMID 23675308.

- ^ “Human housekeeping genes, revisited”. Trends in Genetics 29 (10): 569–74. (October 2013). doi:10.1016/j.tig.2013.05.010. PMID 23810203.
- ^ “Mutagenesis strategies in zebrafish for identifying genes involved in development and disease”. Trends in Genetics 22 (9): 473–8. (September 2006). doi:10.1016/j.tig.2006.06.011. PMID 16844256.
- ^ “About the HGNC”. HGNC Database of Human Gene Names. HUGO Gene Nomenclature Committee. 2015年5月14日閲覧。
- ^ “Recircularization and autonomous replication of a sheared R-factor DNA segment in Escherichia coli transformants”. Proceedings of the National Academy of Sciences of the United States of America 70 (5): 1293–7. (May 1973). Bibcode: 1973PNAS...70.1293C. doi:10.1073/pnas.70.5.1293. PMC 433482. PMID 4576014.
- ^ “Genome-scale engineering for systems and synthetic biology”. Molecular Systems Biology 9 (1): 641. (2013). doi:10.1038/msb.2012.66. PMC 3564264. PMID 23340847.
- ^ “Precision editing of large animal genomes”. Advances in Genetics Volume 80. 80. (2012). pp. 37–97. doi:10.1016/B978-0-12-404742-6.00002-8. ISBN 9780124047426. PMC 3683964. PMID 23084873
- ^ “Gene targeting in plants: 25 years later”. The International Journal of Developmental Biology 57 (6–8): 629–37. (2013). doi:10.1387/ijdb.130194hp. PMID 24166445.
- ^ “Genome engineering using the CRISPR-Cas9 system”. Nature Protocols 8 (11): 2281–2308. (November 2013). doi:10.1038/nprot.2013.143. PMC 3969860. PMID 24157548.
- ^ “Successes and failures in modular genetic engineering”. Current Opinion in Chemical Biology 16 (3–4): 329–36. (August 2012). doi:10.1016/j.cbpa.2012.06.009. PMID 22818777.
- ^ “Personal reflections on the origins and emergence of recombinant DNA technology”. Genetics 184 (1): 9–17. (January 2010). doi:10.1534/genetics.109.112144. PMC 2815933. PMID 20061565.
- ^ “A review of current large-scale mouse knockout efforts”. Genesis 48 (2): 73–85. (February 2010). doi:10.1002/dvg.20594. PMID 20095055.
- ^ “The knockout mouse project”. Nature Genetics 36 (9): 921–4. (September 2004). doi:10.1038/ng0904-921. PMC 2716027. PMID 15340423.
- ^ “In celebration of Dr. Mario R. Capecchi's Nobel Prize”. International Journal of Biological Sciences 3 (7): 417–9. (October 2007). doi:10.7150/ijbs.3.417. PMC 2043165. PMID 17998949.
情報源
- 主要教科書
- Bruce Alberts, Alexander Johnson, Julian Lewis, David Morgan, Martin Raff, Keith Roberts, Peter Walter 著、中村桂子, 松原謙一 訳『細胞の分子生物学 第6版』ニュートンプレス、2017年9月15日。ISBN 978-4315520620。
- Molecular Biology of the Cell (Fourth ed.). New York: Garland Science. (2002). ISBN 978-0-8153-3218-3 – A molecular biology textbook available free online through NCBI Bookshelf.

推薦文献
- ジェームス・D・ワトソン 他 著、中村桂子 監訳, 滋賀陽子 他訳 訳『ワトソン遺伝子の分子生物学 第7版』東京電機大学出版局、2017年1月20日。ISBN 9784501630300。
- ドーキンス,リチャード 著、日高敏隆/岸由二/羽田節子/垂水雄二 訳『利己的な遺伝子 40周年記念版』紀伊國屋書店、2018年2月15日。ISBN 978-4314011532。
- H. Lodishほか 著、堅田利明, 須藤和夫, 山本啓一 訳『分子細胞生物学 第9版』東京化学同人、2023年7月31日。ISBN 9784807920518。
- Bruce Alberts, Karen Hopkin, Alexander Johnson, David Morgan, Martin Raff, Keith Roberts, Peter Walter 著、中村桂子, 松原謙一, 榊佳之, 水島昇 訳『Essential細胞生物学(原書第5版)』南江堂、2021年7月13日。ISBN 978-4-524-22682-5。
- T. A. Brown 著、西郷薫 監訳 訳『ブラウン 分子遺伝学 [第3版]』東京化学同人、1999年3月25日。ISBN 9784807905010。
- Genome: The Autobiography of a Species in 23 Chapters. Fourth Estate. (1999). ISBN 978-0-00-763573-3
- Brown, Terence A. (2023). Genomes 5 (Fifth edition ed.). Boca Raton, FL London New York: CRC Press, Taylor & Francis Group. ISBN 978-0-367-67407-6
外部リンク
- Comparative Toxicogenomics Database - 米国国立環境健康科学研究所による人間の健康と環境暴露の関係を理解することを目的としたデータベース
- DNA From The Beginning – a primer on genes and DNA コールド・スプリング・ハーバー研究所による現代遺伝学の入門書 (英語)
- Gene - アメリカ国立生物工学情報センターによる遺伝子の検索可能なデータベース
- Genes – オープンアクセス専門の出版社MDPIによるオープンアクセスジャーナル
- IMPC (International Mouse Phenotyping Consortium) – 国際マウス表現型解析コンソーシアムによる哺乳類遺伝子機能の百科事典